Η βραχυθεραπεία επί αδενοκαρκινώματος του προστάτη
Η βραχυθεραπεία αποτελεί θεραπεία ευρείας αποδοχής από τους ασθενείς με καρκίνο του προστάτη, κυρίως λόγω των εξαιρετικών αποτελεσμάτων που φέρει στις ομάδες χαμηλού, μεσαίου και υψηλού κινδύνου.
Γράφουν οι
Σκουτέρης Βασίλειος
Κατσώχη Δέσποινα
Ντούνης Αθανάσιος
Μετσίνης Μάριος
Μανίκας Κώστας
Κόλλιας Γεώργιος
Κουτσουβέλη Έφη
Σκουτέρης Μιχαήλ
Κέντρο Βραχυθεραπείας Προστάτη ΥΓΕΙΑ
Η εφαρμογή της, με τη χρήση ειδικού προγράμματος σχεδιασμού θεραπείας του ηλεκτρονικού υπολογιστή, προσφέρει στον πάσχοντα τη δυνατότητα πλήρους ιάσεως, ενώ ταυτόχρονα περιορίζει το φάσμα των μετά τη θεραπεία επιπλοκών στα παροδικά συμπτώματα του ουροποιητικού συστήματος.
Τεχνικές εμφύτευσης
Υπάρχουν δύο τύποι βραχυθεραπείας, η προσωρινή (HDR) και η μόνιμη (LDR). Κατά την πρώτη, η ακτινοβολία παρέχεται μέσω ειδικών βελονών σε 2-3 συνεδρίες, ενώ κατά τη δεύτερη τοποθετούνται μόνιμα ραδιενεργά εμφυτεύματα (CκόκκοιE) εντός του προστάτη. Το Κέντρο Βραχυθεραπείας Προστάτη στο Νοσοκομείο ΥΓΕΙΑ ξεκίνησε το 1996 εφαρμόζοντας την προσωρινή τεχνική εμφύτευσης και μετά, ακολουθώντας τις εξελίξεις, μεταπήδησε στη νεότερη και επικρατούσα μέθοδο μόνιμων εμφυτευμάτων, η οποία θα αναλυθεί διεξοδικά παρακάτω.
Παρ? όλο που η πρώτη επινόηση για διαπερινεϊκή προσπέλαση μέσω διορθικού υπέρηχου το 1983 ανήκει στον Holm, η ιδέα τοποθέτησης πηγών εντός του προστάτη είναι αρκετά παλαιότερη. Ο Alexander Gram Bell ήταν ο πρώτος που περιέγραψε την εμφύτευση ραδιενεργών σωματιδίων στον προστάτη και ο πρώτος που αναγνώρισε τα πιθανά πλεονεκτήματα της ακτινοθεραπείας μικρής απόστασης. Σε ένα γράμμα του, το 1890, ανέφερε την τοποθέτηση Ραδίου μέσα σε γυαλί, με σκοπό να το εισάγει αργότερα στον προστάτη. Η πρώτη πραγματική προσπάθεια έγινε το 1913 από ένα Γάλλο ουρολόγο, ενώ το πρώτο επιστημονικό άρθρο που γράφτηκε ήταν το 1914, περίπου την ίδια περίοδο που έγινε η πρώτη ριζική προστατεκτομή. Ακολούθησαν αρκετοί ερευνητές που χρησιμοποίησαν ραδιενεργές πηγές χρυσού και τις τοποθετούσαν στον προστάτη με μια ανοικτή μέθοδο μέσω του περινέου.
Η νέα εποχή της βραχυθεραπείας του προστάτη ξεκίνησε από το νοσοκομείο Memorial Sloan Kettering Cancer Center, την περίοδο των ανοιχτών οπισθοηβικών εμφυτευμάτων. Από τις αρχές της δεκαετίας του 1970 μέχρι και τα μισά της δεκαετίας του 1980, περισσότεροι από 1.000 ασθενείς υποβλήθηκαν σε ανοιχτή εμφύτευση ραδιενεργών κόκκων. Ο ουρολόγος, αφού παρασκεύαζε χειρουργικά τον προστάτη, υπολόγιζε μαζί με τον ακτινοθεραπευτή ογκολόγο τον όγκο του, ο οποίος με τη βοήθεια ενός νομογράμματος θα καθόριζε την ποσότητα ακτινοβολίας που έπρεπε να εμφυτευτεί. Υπήρχαν αρκετά προβλήματα με την τεχνική αυτή, αλλά το κύριο ήταν ότι ο υπολογισμός του όγκου του προστάτη δεν ήταν ακριβής, με αποτέλεσμα ο αδένας να δέχεται πολύ μικρότερα ποσά ακτινοβολίας από αυτά που απαιτούνταν για τη νέκρωση των καρκινικών εστιών.
Ενώ τα αποτελέσματα της ανοικτής τεχνικής ήταν απογοητευτικά, το ενδιαφέρον των ερευνητών για περαιτέρω εξέλιξη της τεχνικής παρέμεινε αμείωτο. Στις αρχές της δεκαετίας του 1980, ο Holm χρησιμοποίησε υπέρηχο μιας διάστασης και πραγματοποίησε την πρώτη διαπερινεϊκή εμφύτευση κόκκων στον προστάτη. Παρ? όλο που η τεχνική ήταν πρωτόγονη σε σχέση με τις σημερινές, έδειξε ότι τα αποτελέσματα της βραχυθεραπείας στον προστάτη μπορούν να βελτιωθούν με την πρόοδο της τεχνολογίας.
Δύο είναι οι μέθοδοι μόνιμης (LDR) εμφύτευσης που έχουν επικρατήσει σήμερα, η προσχεδιασμένη (preplan) και η πιο εξελιγμένη Real-Time τεχνική.
Την πρώτη και τελειότερη μορφή προσχεδιασμένης τεχνικής βραχυθεραπείας του προστάτη βασιζόμενη σε υπέρηχο, τη δημιούργησε η ομάδα από το Seattle το 1985. Κατά την τεχνική αυτή, οι εικόνες του προστάτη από το διορθικό υπέρηχο λαμβάνονται από τον ουρολόγο στο ιατρείο του και βάσει αυτών δημιουργείται το σχέδιο θεραπείας. Περίπου ένα μήνα μετά, το σχέδιο μεταφέρεται στη χειρουργική αίθουσα, όπου γίνεται προσπάθεια αναπαραγωγής της ίδιας θέσης του ασθενή με αυτήν που χρησιμοποιήθηκε κατά τον προσχεδιασμό. Ο διορθικός υπέρηχος χρησιμοποιείται όχι για να κατευθύνει την τοποθέτηση των κόκκων, αλλά για την ανασύσταση του προσχεδίου και τη διασφάλιση ότι οι βελόνες εισέρχονται σύμφωνα με αυτό στις προκαθορισμένες θέσεις. Στις αρχικές εμφυτεύσεις, η ομάδα του Seattle εφάρμοζε την ομοιόμορφη κατανομή των πηγών σε όλο τον αδένα, με αποτέλεσμα την παροχή υψηλών δόσεων στο κέντρο, όπου βρίσκεται η ουρήθρα. Αυτό δημιουργούσε επιπλοκές αλλά και περιορισμούς στη μέθοδο, όπως αδυναμία εφαρμογής της σε ασθενείς που είχαν υποβληθεί στο παρελθόν σε διουρηθρική προστατεκτομή. Αργότερα, η ομάδα του Seattle στράφηκε προς την περιφερική κατανομή δόσεων, την οποία εφαρμόζει η τεχνική Real-Time, επιτυγχάνοντας εξαιρετικά 15ετή αποτελέσματα και ελάχιστες επιπλοκές.
Η δεύτερη και πλέον εξελιγμένη μέθοδος ονομάζεται Cμέθοδος Real-TimeE και αναπτύχθηκε από τους Stone και Stock στο νοσοκομείο Mount Sinai της Ν. Υόρκης, το 1990. Έχει το πλεονέκτημα ότι ο σχεδιασμός της θεραπείας γίνεται κατά τη διάρκεια της εμφύτευσης και αλλάζει συνεχώς καθώς τοποθετούνται ένας-ένας οι κόκκοι. Αυτό έχει ως αποτέλεσμα τη χορήγηση υψηλών δόσεων στον προστάτη και στις σπερματοδόχους κύστεις, χωρίς ταυτόχρονα να επηρεάζονται οι γύρω ιστοί ή όργανα.
Η διαδικασία ξεκινά με την τοποθέτηση ουροκαθετήρα, ο οποίος διευκολύνει στην ακριβή αναγνώριση των ανατομικών ορίων του προστάτη και της ουρήθρας. Έπειτα, ο ασθενής τοποθετείται σε θέση οπίσθιας λιθοτομής και ο ηχοβολέας του διορθικού υπέρηχου (B&K Medical, type 8848) τοποθετείται στο ορθό κατά τέτοιον τρόπο ώστε να δίνεται η δυνατότητα απεικόνισης όλου του προστάτη σε οβελιαίο αλλά και εγκάρσιο επίπεδο. Η συσκευή υπερήχων (B&K Medical Pro Focus 2202) συνδέεται στο πρόγραμμα σχεδιασμού θεραπείας (VariSeed 7.2, Varian, Palo Alto, CA) του ηλεκτρονικού υπολογιστή, ώστε να μεταφέρεται ζωντανή εικόνα καθ? όλη τη διάρκεια της εμφύτευσης. Μετά λαμβάνονται διαδοχικές εγκάρσιες τομές του προστάτη ανά 5 χιλ., μέσω των οποίων γίνεται ακριβής υπολογισμός του όγκου του προστάτη. Οι τιμές αυτές μεταφέρονται στον υπολογιστή, όπου σχεδιάζεται το αρχικό πλάνο εμφύτευσης, το οποίο περιέχει τον αριθμό βελονών, πηγών και την ολική ενεργότητα που θα εμφυτευθεί.
Πρώτα τοποθετούνται οι περιφερικές βελόνες από τον ουρολόγο, οι οποίες θα καλύψουν το μεγαλύτερο και κεντρικό τμήμα του αδένα. Για τη βάση και την κορυφή προορίζονται οι εσωτερικές βελόνες που τοποθετούνται τελευταίες. Ο ακτινοθεραπευτής ογκολόγος τοποθετεί έναν έναν τους CκόκκουςE, μέσω των βελονών, ενώ ο ακτινοφυσικός ελέγχει την κατανομή των δόσεων, μεταβάλλοντας το πρόγραμμα σχεδιασμού κατά τέτοιον τρόπο ώστε ο προστάτης και οι σπερματοδόχοι κύστεις να λάβουν τη μεγαλύτερη δυνατή ένταση ακτινοβολίας, ενώ η ουρήθρα, το ορθό και ο βολβός του σηραγγώδους σώματος της ουρήθρας τη λιγότερη. Αφού τελειώσει η εμφύτευση, ο ασθενής υποβάλλεται σε ανιούσα κυστεογραφία με C-arm, που θα μας επιβεβαιώσει ότι όλοι οι κόκκοι βρίσκονται στη σωστή θέση. Ένα μήνα μετά, γίνεται μετεμφυτευτική δοσιμετρία, κατά την οποία υπολογίζονται οι δόσεις που έλαβαν όλα τα όργανα μέσω αξονικού τομογράφου.
Ποσοστά ίασης
Ομάδα ασθενών χαμηλού κινδύνου
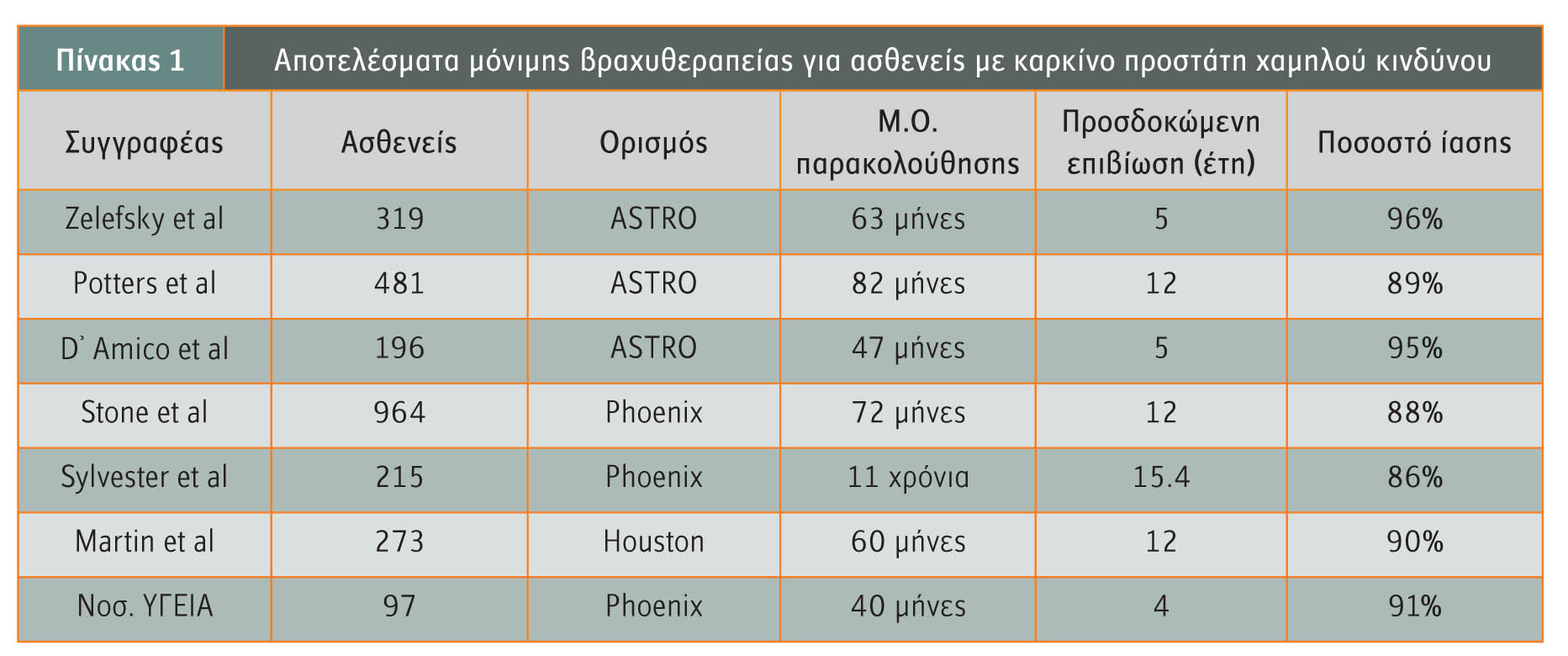
Οι ασθενείς με καρκίνο του προστάτη χαμηλού κινδύνου (PSA <10ng/ml, Gleason ?6 και κλινικό στάδιο ?Τ2α), έχουν την απόλυτη ένδειξη για ένα μόνο θεραπευτικό σχήμα μόνιμης βραχυθεραπείας που θα αποφέρει εξαιρετικά αποτελέσματα.
Αποτελεί κατευθυντήρια οδηγία της Αμερικανικής Εταιρείας Βραχυθεραπείας (ΑΕΒ) ως ιδανική επιλογή για ριζική αντιμετώπιση της νόσου με ελάχιστες επιπλοκές. Το ποσοστό ίασης των ασθενών αυτών στη 15ετία κυμαίνεται από 86% έως 96% (πίνακας 1).
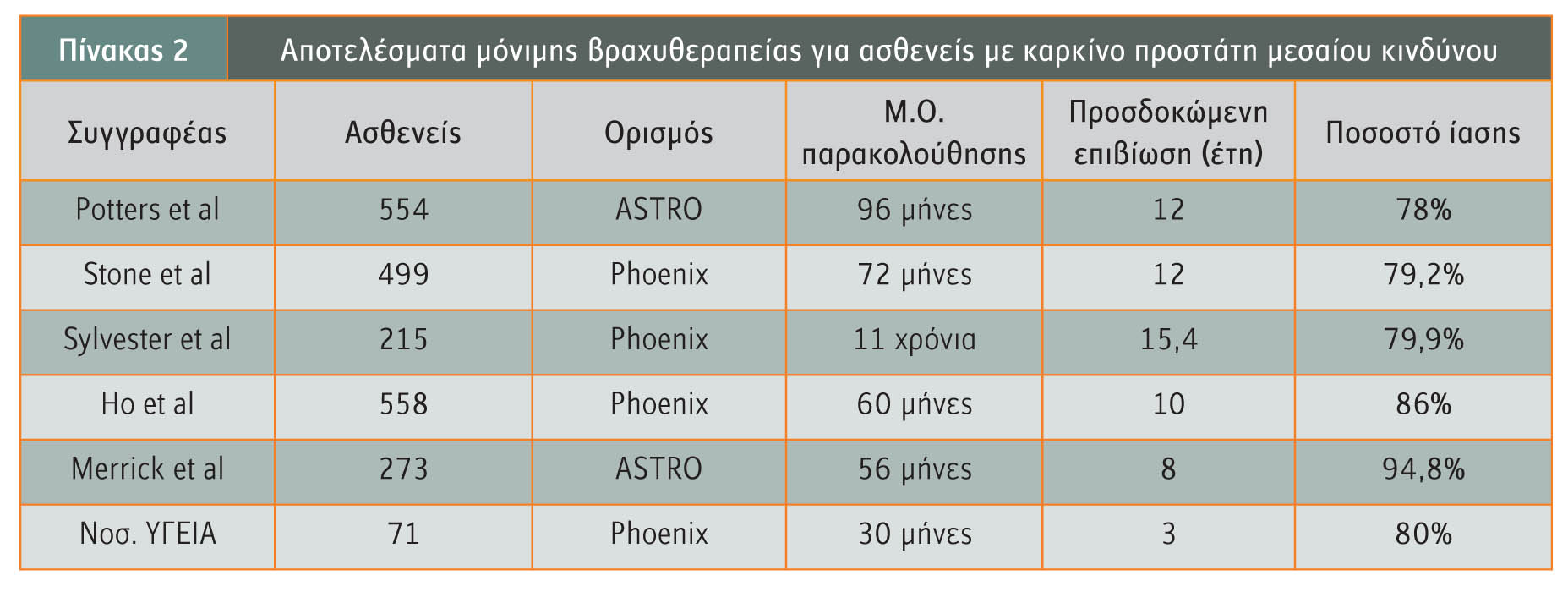
Ομάδα ασθενών μεσαίου κινδύνου
Οι ασθενείς μεσαίου κινδύνου, αυτοί δηλαδή που φέρουν ένα από τα ακόλουθα χαρακτηριστικά, PSA: 10-20ng/ml ή Gleason: 7 ή κλινικό στάδιο: T2b, σύμφωνα με τις κατευθυντήριες οδηγίες της ΑΕΒ, χρειάζονται συνδυασμό δύο τουλάχιστον θεραπειών για να επιτύχουν το υψηλότερο ποσοστό ίασης. Στο νοσοκομείο Mount Sinai το πρωτόκολλο αποτελείται από 6 μήνες ολικό ανδρογονικό αποκλεισμό (3 μήνες νέο επικουρικό) και βραχυθεραπεία ολικής δόσης. Μία επιθετικότερη εναλλακτική μορφή θεραπείας αποτελεί η προσθήκη συμπληρωματικής εξωτερικής ακτινοβολίας (45Gy) στη μερική εμφύτευση (107Gy), η οποία προτείνεται από αρκετά κέντρα, αν και οι αντίστοιχες κλινικές μελέτες δεν έχουν ολοκληρωθεί ακόμα, όταν υπάρχουν στοιχεία που καθιστούν τη νόσο πιο επιθετική (υψηλό ποσοστό θετικών βιοψιών, περινευρική διήθηση κ.λπ.). Οι ασθενείς της ομάδας αυτής έχουν ποσοστά ίασης 78%-95% (πίνακας 2).
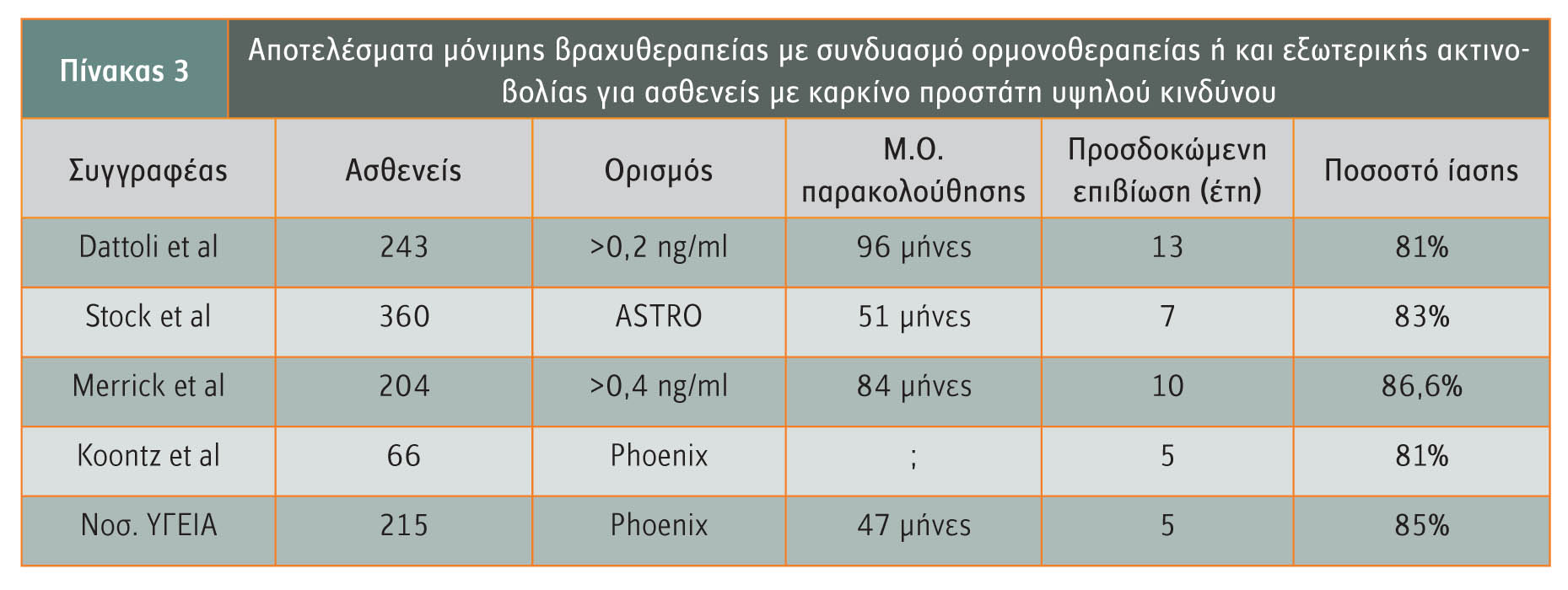
Ομάδα ασθενών υψηλού κινδύνου
Οι ασθενείς υψηλού κινδύνου, αυτοί δηλαδή που φέρουν δύο χαρακτηριστικά μεσαίου κινδύνου ή τουλάχιστον ένα από τα παρακάτω: PSA >20ng/ml, Gleason :8-10, ή κλινικό στάδιο ?Τ3a, είναι γνωστό ότι επιτυγχάνουν απογοητευτικά αποτελέσματα όταν επιλέγουν μία μόνο θεραπεία και όχι κάποιο συνδυαστικό σχήμα. Στο νοσοκομείο Mount Sinai εφαρμόζεται ο συνδυασμός τριών θεραπειών (9 μήνες ορμονοθεραπεία, μερική βραχυθεραπεία – 107Gy και συμπληρωματική εξωτερική ακτινοβολία – 45Gy), που παρουσιάζει εξαιρετικά αποτελέσματα στη δύσκολη αυτή ομάδα ασθενών, πολύ ανώτερα από οποιαδήποτε μορφή μονοθεραπείας (πίνακας 3).
Επιπλοκές
Οι επιπλοκές μετά την εφαρμογή της πιο εξελιγμένης τεχνικής Real-Time βραχυθεραπείας του προστάτη, δεν είναι σοβαρές και γενικά επηρεάζουν ελάχιστα και παροδικά τις φυσιολογικές δραστηριότητες του ασθενή. Η πιθανότητα εμφάνισης επίσχεσης ούρων το πρώτο 48ωρο μετά την εμφύτευση ανέρχεται στο 5% και έχει άμεση συσχέτιση με την ποιότητα της ούρησης προ θεραπείας (υψηλό IPSS). Οφείλεται στο παροδικό οίδημα που προκαλείται από την είσοδο των βελονών και αντιμετωπίζεται με την τοποθέτηση καθετήρα Foley για 2-3 ημέρες. Ακράτεια ούρων δεν παρατηρείται και η στυτική λειτουργία παραμένει ως είχε, κατά 70%-90%, αναλόγως την ηλικία του ασθενή και το βαθμό ικανότητάς του προ του χειρουργείου.
Τα συμπτώματα από το γαστρεντερικό είναι και αυτά ήπιας μορφής και οφείλονται στην φλεγμονώδη αντίδραση από την ακτινοβολία που, αν και κυμαίνεται σε χαμηλά επίπεδα, αναγκαστικά εκτείνεται από τον προστάτη στο βλεννογόνο του ορθού. Ελαφράς μορφής πρωκτίτιδα (1ου ή 2ου βαθμού) εμφανίζεται στο 8% των ασθενών και αντιμετωπίζεται συντηρητικά. Οποιαδήποτε επιθετική αντιμετώπιση (λήψη βιοψιών, καυτηριασμός, κ.λπ.) πρέπει να αποφεύγεται αυστηρά, λόγω του μεγάλου κινδύνου εμφάνισης έλκους ή συριγγίου.
Τα τελευταία χρόνια μεγάλο ενδιαφέρον αναπτύσσεται όσον αφορά την πρόγνωση των επιπλοκών μετά την ακτινοθεραπεία, μέσω εξετάσεων του γενετικού υλικού. Σε σειρά διαφόρων εργασιών έχει φανεί συσχέτιση της εμφάνισης επιπλοκών μετά από βραχυθεραπεία και την παρουσία μετάλλαξης στο γονίδιο ATM. Έτσι, οι ασθενείς αυτοί είχαν μεγαλύτερη πιθανότητα εμφάνισης δυσουρικών ενοχλημάτων ή πρωκτίτιδας. Στο μέλλον και καθώς το κόστος των γεννητικών εξετάσεων συνεχώς μειώνεται, ίσως να μπορούμε να προβλέψουμε με ακρίβεια τις επιπλοκές που ενδέχεται να εμφανιστούν ανά ασθενή μετά από οποιασδήποτε μορφής ακτινοθεραπεία και έτσι να τον συμβουλέψουμε ορθότερα, ώστε να επιλέξουν τη θεραπεία με το καλύτερο δυνατό αποτέλεσμα για τον καρκίνο του προστάτη.

Εικ. 1. Πραγματικό μέγεθος ραδιενεργών κόκκων.
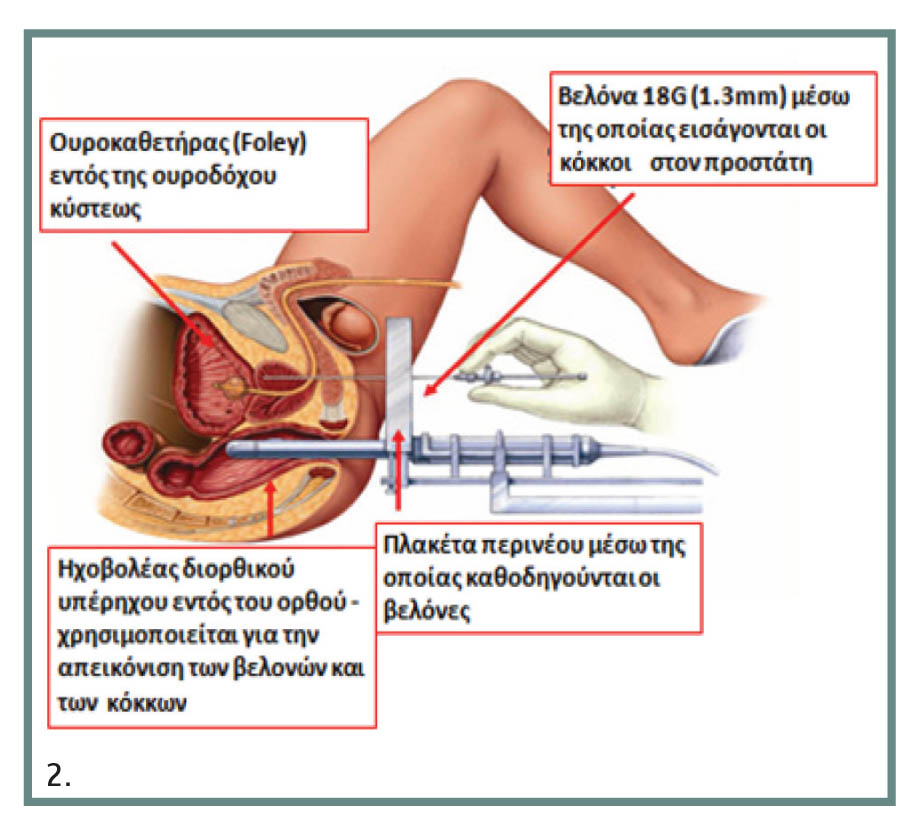
Εικ. 2. Σχηματική παράσταση που εμφανίζει τη διαδικασία της βραχυθεραπείας του προστάτη.
Bιβλιογραφία
Holm HH, Pedersen JF, Hansen H, Stroyer I. Transperineal I-125 iodine seed implantation in prostatic cancer guided by transrectal ultrasonography. J Urol 1983; 130: 283-286.
Bell AG. The uses of radium. Am Med 1903; 6: 261.
Whitmore WF, Hilaris B, Grabstald H. Retropubic implantation of Iodine 125 in the treatment of prostate cancer. J Urol 1972; 108: 918-920.
Sylvester JE, Grimm PD, Wong J, Galbreath RW, Merrick G, Blasko JC. Fifteen-year biochemical relapse-free survival, cause-specific survival, and overall survival following I(125) prostate brachytherapy in clinically localized prostate cancer: Seattle experience. Int J Radiat Oncol Biol Phys. 2011 Oct 1; 81 (2): 376-81. Epub 2010 Sep 23.
Stone NN, Stone MM, Rosenstein BS, Unger P, Stock RG. Influence of pretreatment and treatment factors on intermediate to long-term outcome after prostate brachytherapy. J Urol. 2011 Feb; 185 (2): 495-500. Epub 2010 Dec 17.
Stock RG, Stone NN, Cesaretti JA, Rosenstein BS. Biologically effective dose values for prostate brachytherapy: effects on PSA failure and posttreatment biopsy results. Int J Radiat Oncol Biol Phys. 2006 Feb 1; 64 (2): 527-533. Epub 2005 Oct 19.
Davis BJ, Horwitz EM, Lee WR, Crook JM, Stock RG, Merrick GS, Butler WM, Grimm PD, Stone NN, Potters L, Zietman AL, Zelefsky MJ. American Brachytherapy Society consensus guidelines for transrectal ultrasound-guided permanent prostate brachytherapy. Brachytherapy. 2012 Jan; 11 (1): 6-19.
Stock RG, Cahlon O, Cesaretti JA, Kollmeier MA, Stone NN. Combined modality treatment in the management of high-risk prostate cancer. Int J Radiat Oncol Biol Phys. 2004 Aug 1; 59 (5): 1.352-1.359.
Stone NN, Gerber NK, Blacksburg S, Stone J, Stock RG. Factors influencing urinary symptoms 10 years after permanent prostate seed implantation. J Urol. 2012 Jan; 187 (1): 117-123. Epub 2011 Nov 23.
Cesaretti JA, Stock RG, Lehrer S, Atencio DA, Bernstein JL, Stone NN, Wallenstein S, Green S, Loeb K, Kollmeier M, Smith M, Rosenstein BS. ATM sequence variants are predictive of adverse radiotherapy response among patients treated for prostate cancer. Int J Radiat Oncol Biol Phys. 2005 Jan 1; 61 (1): 196-202.
Zelefsky MJ, Yamada Y, Cohen GN, Shippy A, Chan H, Fridman D, Zaider M. Five-year outcome of intraoperative conformal permanent I-125 interstitial implantation for patients with clinically localized prostate cancer. Int J Radiat Oncol Biol Phys. 2007 Jan 1; 67 (1): 65-70.
Potters L, Morgenstern C, Calugaru E, Fearn P, Jassal A, Presser J, Mullen E. 12-year outcomes following permanent prostate brachytherapy in patients with clinically localized prostate cancer. J Urol. 2005 May; 173 (5): 1.562-1.566.
D’amico AV, Tempany CM, Schultz D, Cormack RA, Hurwitz M, Beard C, Albert M, Kooy H, Jolesz F, Richie JP. Comparing PSA outcome after radical prostatectomy or magnetic resonance imaging-guided partial prostatic irradiation in select patients with clinically localized adenocarcinoma of the prostate. Urology. 2003 Dec; 62 (6): 1.063-1.067.
Martin AG, Roy J, Beaulieu L, Pouliot J, Harel F, Vigneault E. Permanent prostate implant using high activity seeds and inverse planning with fast simulated annealing algorithm: A 12-year Canadian experience. Int J Radiat Oncol Biol Phys. 2007 Feb 1; 67 (2): 334-341. Epub 2006 Nov 2.
Merrick GS, Butler WM, Wallner KE, Galbreath RW, Allen ZA, Adamovich E. The impact of primary Gleason grade on biochemical outcome following brachytherapy for hormone-naive Gleason score 7 prostate cancer. Cancer J. 2005 May-Jun; 11 (3): 234-240.
Ho AY, Burri RJ, Cesaretti JA, Stone NN, Stock RG. Radiation dose predicts for biochemical control in intermediate-risk prostate cancer patients treated with low-dose-rate brachytherapy. Int J Radiat Oncol Biol Phys. 2009 Sep 1; 75 (1): 16-22. Epub 2009 Mar 14.
Dattoli M, Wallner K, True L, Cash J, Sorace R. Long-term prostate cancer control using palladium-103 brachytherapy and external beam radiotherapy in patients with a high likelihood of extracapsular cancer extension. Urology. 2007 Feb; 69 (2): 334-337.
Stock RG, Cesaretti JA, Stone NN. Disease-specific survival following the brachytherapy management of prostate cancer. Int J Radiat Oncol Biol Phys. 2006 Mar 1; 64 (3): 810-816. Epub 2005 Nov 23.
Merrick GS, Butler WM, Wallner KE, Galbreath RW, Allen ZA, Adamovich E, Lief J. Androgen deprivation therapy does not impact cause-specific or overall survival in high-risk prostate cancer managed with brachytherapy and supplemental external beam. Int J Radiat Oncol Biol Phys. 2007 May 1; 68 (1): 34-40. Epub 2007 Feb 7.
Koontz BF, Chino J, Lee WR, Hahn CA, Buckley N, Huang S, Kim J, Reagan R, Joyner R, Anscher MS. Morbidity and prostate-specific antigen control of external beam radiation therapy plus low-dose-rate brachytherapy boost for low, intermediate, and high-risk prostate cancer. Brachytherapy. 2009 Apr-Jun; 8 (2): 191-196.
Δεκέμβριος 2012