Μη αλκοολική λιπώδης νόσος του ήπατος (NAFLD)
Η μη αλκοολική λιπώδης νόσος του ήπατος είναι σήμερα μία από τις συχνότερες αιτίες χρόνιας ηπατοπάθειας παγκοσμίως, η συχνότερη σε κάποιες χώρες, ιδιαίτερα σε πληθυσμούς με υψηλό ποσοστό παχυσαρκίας.
Γράφουν οι,
Δημήτριος Τσαντούλας
Ηπατολόγος, «ΥΓΕΙΑ»
Ελένη Χρυσανθοπούλου
Ηπατολόγος, «ΥΓΕΙΑ»
Τα τελευταία χρόνια έχει σημειωθεί σημαντική πρόοδος σε σχέση με τη φυσική ιστορία, την αιτιολογία, την παθογένεια και τη θεραπεία αυτής της ευρέως κλινικού φάσματος ηπατοπάθειας.
Οι ασθενείς στην πλειονότητά τους είναι ασυμπτωματικοί ή με ελάχιστα συμπτώματα και η νόσος αποκαλύπτεται τυχαία σε κάποιο βιοχημικό ή απεικονιστικό έλεγχο ρουτίνας. Απαραίτητη προϋπόθεση για τη διάγνωση είναι η αποχή από την κατανάλωση αλκοόλ σε ποσότητα πέραν των ασφαλών ορίων (άνδρες: 3 μονάδες/ημέρα, γυναίκες: 2 μονάδες/ημέρα).
Επιδημιολογία
Η παραπάνω προϋπόθεση και η διαγνωστική δυσχέρεια (έλλειψη ορολογικού δείκτη, απουσία βιοψίας ήπατος) καθιστούν δύσκολες τις επιδημιολογικές μελέτες της μη αλκοολικής λιπώδους νόσου του ήπατος. Με βάση απεικονιστικές κυρίως μεθόδους (συνήθως υπερηχογράφημα), ο επιπολασμός της λιπώδους διήθησης στο γενικό πληθυσμό αναφέρεται στις διάφορες χώρες από 9% μέχρι 30%. Ο επιπολασμός της μη αλκοολικής στεατοηπατίτιδας, για τη διάγνωση της οποίας απαιτείται βιοψία ήπατος, υπολογίζεται μεταξύ 2% και 7% του γενικού πληθυσμού.
Στην Ελλάδα ο επιπολασμός της μη αλκοολικής λιπώδους νόσου του ήπατος υπολογίζεται σε 15% – 20% (17,6% σε μελέτες αιμοδοτών).
Σε ασθενείς με δείκτη μάζας σώματος (BMI) >35 Kg/m2 ο επιπολασμός της απλής στεάτωσης φθάνει το 76%, της στεατοηπατίτιδας το 23% και της κίρρωσης το 6%, ενώ σε διαβητικούς ασθενείς ηπατική στεάτωση ανευρίσκεται σε ποσοστό 40% – 70%.
Στα παιδιά υπάρχουν μελέτες που δείχνουν ποσοστό μη αλκοολικής λιπώδους νόσου του ήπατος γύρω στο 3%, ενώ σε παχύσαρκα παιδιά ξεπερνά το 50%.
Από τα παραπάνω στοιχεία φαίνεται το μέγεθος του προβλήματος. Η σοβαρότητά του, όμως, εξαρτάται από την παρουσία ή όχι στεατοηπατίτιδας (NASH), η οποία χαρακτηρίζεται από φλεγμονή και ίνωση, αύξηση των τρανσαμινασών και της γGT και επιβεβαιώνεται μόνο με ιστολογική εξέταση (εικόνα λιπώδους διήθησης και στεατοηπατίτιδας).
Η μη αλκοολική στεατοηπατίτιδα εξελίσσεται σε κίρρωση (15% – 20%), ενώ τότε δεν είναι σπάνια και η ανάπτυξη ηπατοκυτταρικού καρκίνου.
Ο κυριότερος παράγοντας κινδύνου για την ανάπτυξη NAFLD είναι η παχυσαρκία, πιθανώς μέσω ανάπτυξης αντίστασης στην ινσουλίνη.
Στην ιταλική μελέτη Dionysos ο επιπολασμός της NAFLD βρέθηκε σε ποσοστά 94%, 67% και 24,5% αντίστοιχα σε παχύσαρκα, υπέρβαρα και φυσιολογικού βάρους άτομα.
Αναφέρθηκε ήδη η επιβαρυντική παρουσία του σακχαρώδη διαβήτη τύπου ΙΙ.
Γενετικοί παράγοντες φαίνεται να παίζουν κάποιο ρόλο στην εμφάνιση και εξέλιξη της νόσου, καθώς μερικές επιδημιολογικές μελέτες δείχνουν αυξημένη επίπτωση της NAFLD και της αντίστασης στην ινσουλίνη σε πρώτου βαθμού συγγενείς ασθενών με NAFLD, ενώ υπάρχουν σημαντικές φυλετικές διαφορές (χαμηλότερα ποσοστά NAFLD στους μαύρους).
Πειραματικές ενδείξεις συσχέτισης διαιτητικών συνηθειών με την ανάπτυξη NAFLD, μέσω πιθανών αλλαγών στην ευαισθησία στην ινσουλίνη και στο μεταγευματικό μεταβολισμό των τριγλυκεριδίων, δεν έχουν επαληθευθεί επαρκώς από κλινικές μελέτες.
Διάγνωση
Ενώ η διάγνωση της απλής λιπώδους διήθησης (στεάτωσης) του ήπατος όταν αφορά σε ποσοστό >5% των ηπατοκυττάρων γίνεται σχετικά εύκολα με απεικονιστικές μεθόδους, κυρίως με υπερηχογράφημα (εικόνα 1), που είναι πολύ πιο εύχρηστο από την αξονική ή τη μαγνητική τομογραφία, για τη διάγνωση της στεατοηπατίτιδας η πιο αξιόπιστη μέθοδος είναι η βιοψία ήπατος (εικόνα 2).
Η χρήση του δείκτη NAS (NAFLD Activity Score), που προκύπτει από το άθροισμα της ημιποσοτικής εκτίμησης της στεάτωσης (0 – 3), της λοβιδιακής φλεγμονής (0 – 3) και της ηπατοκυτταρικής εξοίδησης (0 – 2) δεν τυγχάνει ευρείας αποδοχής.
Από τους διάφορους δείκτες ηπατικής ίνωσης που έχουν κατά καιρούς προταθεί, η ελαστογραφία (Fibroscan) είναι ο πιο αξιόπιστος και χρησιμοποιείται όλο και περισσότερο και για την αρχική εκτίμηση αλλά και για την παρακολούθηση της εξέλιξης της ίνωσης.
Τα ΑΝΑ σε χαμηλό τίτλο (σπάνια >1/320) είναι δυνατόν να ανιχνευθούν στο 1/3 των περιπτώσεων NAFLD, δε φαίνεται όμως να έχουν παθογενετικό ενδιαφέρον. Βέβαια, ασθενείς με τίτλους ΑΝΑ >1/160 χρήζουν περαιτέρω διερεύνησης με βιοψία ήπατος.
Ελαφρά αυξημένη φερριτίνη φαίνεται να συνδέεται με την παρουσία του μεταβολικού συνδρόμου.
Στον αλγόριθμο διάγνωσης της NAFLD πρέπει να συμπεριληφθεί ο αποκλεισμός της χρόνιας ηπατίτιδας Β και C, της νόσου του Wilson και της ανεπάρκειας α1-αντιθρυψίνης, ενώ ιδιαίτερη σημασία χρειάζεται να δοθεί στην προσεκτική λήψη ιατρικού ιστορικού, δεδομένου ότι αρκετά φάρμακα (π.χ. ταμοξιφαίνη, μεθοτρεξάτη, αμιοδαρόνη) μπορούν να προκαλέσουν ηπατική στεάτωση.
Ιδιαίτερα θα πρέπει να τονισθεί η στενή σχέση μεταξύ HCV λοίμωξης και στεάτωσης, που παρατηρείται σε αυξημένη συχνότητα (55%) σε ασθενείς με χρόνια ηπατίτιδα C, σε σχέση με το γενικό πληθυσμό (20% – 30%).
Αρκετά επιδημιολογικά στοιχεία δείχνουν ότι ασθενείς με χρόνια HCV λοίμωξη παρουσιάζουν αυξημένο κίνδυνο εμφάνισης αντίστασης στην ινσουλίνη και σακχαρώδη διαβήτη, ο οποίος κυμαίνεται από 21% μέχρι 50%.
Θα πρέπει να αναφερθεί ότι επιτυχής αντιιική θεραπεία φαίνεται να επαναφέρει την ευαισθησία στην ινσουλίνη σε άτομα με χρόνια HCV λοίμωξη. Για τους παραπάνω λόγους, η εξέταση των ασθενών με NAFLD πρέπει να κατευθύνεται και προς τον αποκλεισμό της HCV λοίμωξης.
Παθογένεια
Η παθογένεια της μη αλκοολικής λιπώδους νόσου του ήπατος δεν είναι πλήρως διευκρινισμένη και κατανοητή. Φαίνεται, όμως, ότι πρωταρχικό ρόλο παίζει η αντίσταση στην ινσουλίνη, κύριο χαρακτηριστικό του μεταβολικού συνδρόμου, του οποίου η συσχέτιση με την NAFLD τελευταία αναγνωρίζεται όλο και περισσότερο.
Το μεταβολικό σύνδρομο (αρχικά σύνδρομο Χ) πρωτοπεριγράφηκε πριν από 20 χρόνια με σημαντικές μεταβολικές διαταραχές. Πέραν της αντίστασης στην ινσουλίνη, συνυπάρχουν παχυσαρκία (ιδιαίτερα κοιλιακή), σακχαρώδης διαβήτης τύπου ΙΙ, υπέρταση και δυσλιπιδαιμία (υψηλά τριγλυκερίδια, χαμηλή HDL).
Ποσοστό περίπου 90% των ασθενών με NAFLD έχει τουλάχιστον ένα χαρακτηριστικό στοιχείο του μεταβολικού συνδρόμου, ενώ στο 1/3 των ασθενών αναγνωρίζεται το πλήρες φάσμα του συνδρόμου. Έτσι, σήμερα η NAFLD θεωρείται ότι αποτελεί την ηπατική εκδήλωση του μεταβολικού συνδρόμου.
Η στεάτωση ή λιπώδης διήθηση του ήπατος χαρακτηρίζεται από συσσώρευση λιπιδίων, ειδικότερα τριγλυκεριδίων, στα ηπατοκύτταρα.
Υπό φυσιολογικές συνθήκες, σε κατάσταση νηστείας στο λιπώδη ιστό ενεργοποιείται η λιποπρωτεϊνική κινάση, η οποία υδρολύει τα αποθηκευμένα τριγλυκερίδια και με τα παραγόμενα ελεύθερα λιπαρά οξέα προσφέρει ενέργεια στον οργανισμό.
Μεταγευματικά η εκκρινόμενη ινσουλίνη αναστέλλει τη δράση της λιποπρωτεϊνικής λιπάσης, αφού η απαιτούμενη ενέργεια προκύπτει από το μεταβολισμό των υδατανθράκων.
Σε παρουσία αντίστασης στην ινσουλίνη η δράση της λιποπρωτεϊνικής λιπάσης δεν αναστέλλεται, η λιπόλυση δεν καταστέλλεται επαρκώς, με συνέπεια τη συνεχώς αυξημένη παραγωγή και την αυξημένη κυκλοφορία λιπαρών οξέων, τα οποία μέσω της πυλαίας φθάνουν στο ήπαρ, αποτελώντας τον πρωταρχικό μηχανισμό της δημιουργίας στεάτωσης στα ηπατοκύτταρα.
Οι Day και James πρότειναν το 1998 την υπόθεση των δύο πληγμάτων για την ερμηνεία αφενός της απλής στεάτωσης του ήπατος και αφετέρου της εξέλιξης σε φλεγμονή, ίνωση και κίρρωση.
Για το «πρώτο πλήγμα», λοιπόν, πρωταρχική διαταραχή είναι η συσσώρευση λίπους στα ηπατοκύτταρα από αυξημένη πρόσληψη λιπαρών οξέων, είτε από την κυκλοφορία είτε από de novo σύνθεση, σε συνδυασμό με μειωμένο μεταβολισμό τους, μέσω β-οξείδωσης ή αποβολής τους με τη μορφή VLDL.
Στο φυσιολογικό ηπατοκύτταρο τα εισερχόμενα ελεύθερα χολικά οξέα ή τα de novo παραγόμενα στο ηπατοκύτταρο είτε υφίστανται εστεροποίηση που οδηγεί σε παραγωγή τριγλυκεριδίων, μέρος των οποίων εξέρχεται από το ηπατοκύτταρο ως πολύ χαμηλής πυκνότητας λιποπρωτεΐνες (VLDL), είτε οξειδώνονται κυρίως στα μιτοχόνδρια. Σε ασθενείς με NAFLD τα αυξημένα επίπεδα λιπιδίων, κυρίως ως τριγλυκερίδια, μέσα στο ηπατοκύτταρο είναι αποτέλεσμα διαταραχής της ισορροπίας μεταξύ των ενζυμικών συστημάτων που προάγουν την πρόσληψη και σύνθεση λιπαρών οξέων και εκείνων που προάγουν την οξείδωση και την έξοδό τους.
Η αντίσταση στην ινσουλίνη οδηγεί στη συσσώρευση λίπους στα ηπατοκύτταρα μέσω δύο κυρίως μηχανισμών:
- Της λιπόλυσης, που αυξάνει την ποσότητα των ελεύθερων λιπαρών οξέων στην κυκλοφορία (ιδιαίτερα στην πυλαία, από τον κοιλιακό λιπώδη ιστό).
- Της δημιουργούμενης υπερινσουλιναιμίας.
Η αυξημένη πρόσληψη ελεύθερων λιπαρών οξέων οδηγεί σε υπερφόρτωση της μιτοχονδριακής β-οξείδωσης, με συνέπεια τη συσσώρευση λιπαρών οξέων στο ηπατοκύτταρο.
Από την άλλη πλευρά, η υπερινσουλιναιμία που παράγεται λόγω αντίστασης στην ινσουλίνη αυξάνει τη σύνθεση λιπαρών οξέων στα ηπατοκύτταρα, αυξάνοντας τη γλυκόλυση, και ευνοεί τη συσσώρευση τριγλυκεριδίων στα ηπατοκύτταρα επειδή ελαττώνει την ηπατική παραγωγή απολιποπρωτεΐνης Β-100.
Οι παραπάνω αναφερθέντες μηχανισμοί επιφέρουν το «πρώτο πλήγμα», με συνέπεια τη στεάτωση.
Για τη δημιουργία στεατοηπατίτιδας απαιτείται και «δεύτερο πλήγμα», που προέρχεται από τα παρακάτω: τα συσσωρευμένα εντός του ηπατοκυττάρου ελεύθερα λιπαρά οξέα αποτελούν υπόστρωμα αλλά και επαγωγέα των μικροσωμιακών λιποξυγενασών κυττοχρώματος P-450 E1 και 4 Α, το επίπεδο των οποίων αυξάνεται στο ήπαρ ασθενών με στεατοηπατίτιδα και πιθανότατα συντελούν στην υπερπαραγωγή ηπατοτοξικών ελεύθερων ριζών οξυγόνου, ικανών να οδηγήσουν σε υπεροξείδωση των λιπιδίων της ηπατοκυτταρικής μεμβράνης.
Επιπλέον, στροφή προς τη β-οξείδωση των ελεύθερων χολικών οξέων, επί προϋπάρχουσας μειονεκτικότητας στη μιτοχονδριακή οξειδωτική φωσφορυλίωση, μπορεί να έχει ως αποτέλεσμα το σχηματισμό αυξημένων ποσοτήτων τοξικών ελεύθερων ριζών, την ηπατοκυτταρική βλάβη και την ίνωση.
Εφόσον με τους παραπάνω μηχανισμούς έχει εγκατασταθεί ηπατική στεάτωση, άλλοι παράγοντες, όπως η υπεροξείδωση των λιπιδίων, η δημιουργία ελεύθερων ριζών οξυγόνου, τα άφθονα λιπαρά οξέα και το οξειδωτικό stress, επιφέρουν «δεύτερο πλήγμα» που οδηγεί σε φλεγμονή, νέκρωση και ίνωση (στεατοηπατίτιδα – NASH).
Πολλοί ερευνητές υποστηρίζουν ότι, πέραν της παρουσίας αντίστασης στην ινσουλίνη, η ανάπτυξη σοβαρής ηπατοκυτταρικής βλάβης στην NAFLD απαιτεί την ύπαρξη και άλλων παραγόντων που συντελούν στη δημιουργία οξειδωτικού stress.
Τέτοιοι παράγοντες είναι:
- Η μεγάλη ελάττωση των αντιοξειδωτικών ενζύμων, όπως της γλουταθειόνης, της βιταμίνης Ε, της βιταμίνης C, από την υπεροξείδωση του λίπους και τις ελεύθερες ρίζες οξυγόνου, η οποία καθιστά το ήπαρ ιδιαίτερα ευαίσθητο στην οξειδωτική βλάβη.
- Αυξημένος σίδηρος στο ήπαρ φαίνεται να σχετίζεται με τη σοβαρότητα της ηπατικής ίνωσης, ο μηχανισμός δράσης του όμως παραμένει άγνωστος.
- Η λεπτίνη είναι ένα πεπτίδιο που παράγεται κυρίως στο λιπώδη ιστό, αποτελεί προφλεγμονώδη κυτταροκίνη και ενεργοποιεί τα αστεροειδή κύτταρα προάγοντας την ίνωση.
- Η αδιπονεκτίνη, άλλη μία λιποκίνη, είναι ηπατοπροστατευτική ορμόνη με αντιφλεγμονώδη δράση που βελτιώνει την αντίσταση στην ινσουλίνη, αλλά ελαττώνεται στην παχυσαρκία.
- Η ανάπτυξη βακτηριδίων στο έντερο ευνοεί την ηπατοκυτταρική βλάβη μέσω είτε υπερπαραγωγής ακεταλδεύδης είτε ενδοτοξινών που εισέρχονται στην ηπατική κυκλοφορία.
- Σημαντικό ρόλο στη δημιουργία φλεγμονής και ίνωσης παίζει ο TNF-a.
Θεραπεία
Το θεραπευτικό οπλοστάσιο για την αντιμετώπιση της NAFLD συνεχώς εμπλουτίζεται, χωρίς βέβαια να υπάρχει ακόμα αποτελεσματική θεραπεία για τους κύριους στόχους, δηλαδή τη βελτίωση της αντίστασης στην ινσουλίνη και τη μείωση του φλεγμονώδους μικροπεριβάλλοντος, οπότε να προληφθεί ή να καθυστερήσει η ανάπτυξη στεατοηπατίτιδας.
Υπό τις συνθήκες απουσίας ειδικής θεραπείας, η προσπάθεια εστιάζεται στην αντιμετώπιση των παραμέτρων του μεταβολικού συνδρόμου, δηλαδή της παχυσαρκίας, της δυσλιπιδαιμίας και του σακχαρώδους διαβήτη.
Η αντίσταση στην ινσουλίνη, η οποία, όπως αναφέρθηκε, θεωρείται ότι διαδραματίζει κεντρικό ρόλο στη δημιουργία της NAFLD και ιδιαίτερα της NASH, της μορφής που κυρίως απαιτεί θεραπεία, είναι ένας σημαντικός στόχος της θεραπευτικής αντιμετώπισης. Η προσέγγισή του είναι δυνατή με τρεις τρόπους: απώλεια βάρους, χειρουργική παρέμβαση και φαρμακευτικές ουσίες.
Προτείνεται απώλεια βάρους 10% ως αρχικός στόχος, εάν το ΒΜΙ είναι μεγαλύτερο από 25 Kg/m2. Η απώλεια δεν πρέπει να είναι ταχεία (όχι περισσότερο από 1 Kg την εβδομάδα, γιατί μπορεί έτσι να προκληθεί επιδείνωση της στεατοηπατίτιδας από την απελευθέρωση μεγάλης ποσότητας ελεύθερων χολικών οξέων από το λιπώδη ιστό). Προτείνεται δίαιτα φτωχή σε υδατάνθρακες και κεκορεσμένα λίπη, πλούσια σε φρούτα και λαχανικά, σε συνδυασμό με μέτριας έντασης αερόβια άσκηση (30 – 40 λεπτά, 5 – 7 φορές εβδομαδιαίως).
Η μεταβολισμική χειρουργική είναι μια καλή επιλογή για άτομα με κακοήθη παχυσαρκία.
Ουσίες που τροποποιούν την ευαισθησία στην ινσουλίνη αξιολογούνται εντατικά τα τελευταία χρόνια όσον αφορά στην ασφάλειά τους και στην ικανότητά τους να προκαλούν ιστολογική βελτίωση (δηλαδή βελτίωση της φλεγμονής και της ίνωσης).
Μια ομάδα τέτοιων ουσιών είναι οι θειαζολιδινεδιόνες. Είναι αγωνιστές του peroxisome proliferator-activated receptor-γ (PPAR-γ) και βελτιώνουν σημαντικά την ευαισθησία στην ινσουλίνη, ενώ διαθέτουν επίσης αντιφλεγμονώδη και αντιινωτική δράση. Η τρογλιταζόνη ήταν το πρώτο σκεύασμα που δοκιμάστηκε, αλλά αποσύρθηκε λόγω σοβαρής ηπατοτοξικότητας. Οι δεύτερης γενιάς θειαζολιδινεδιόνες, δηλαδή η πιογλιταζόνη και η ροσιγλιταζόνη, έχουν δοκιμασθεί σε ασθενείς με μη αλκοολική στεατοηπατίτιδα με ενθαρρυντικά αποτελέσματα. Η πιογλιταζόνη χορηγούμενη σε δόση 30 mg ημερησίως για 48 εβδομάδες πέτυχε σημαντική μείωση των τρανσαμινασών, με επίτευξη φυσιολογικών τιμών στο 72% των ασθενών που συμμετείχαν στη μελέτη. Η ιστολογική εξέταση του ήπατος έδειξε σημαντική μείωση της στεάτωσης, της ηπατοκυτταρικής βλάβης, της φλεγμονής και της ίνωσης.
Η μετφορμίνη δρα μειώνοντας την ηπατική παραγωγή γλυκόζης και αυξάνοντας την πρόσληψή της από τους σκελετικούς μυς. Αυξάνει την οξείδωση των λιπαρών οξέων και καταστέλλει τη λιπογένεση. Επίσης, μειώνει την υπερινσουλιναιμία και βελτιώνει την αντίσταση στην ινσουλίνη χωρίς τον κίνδυνο της υπογλυκαιμίας. Μικρές μελέτες έχουν δείξει ικανοποιητικά αποτελέσματα της μετφορμίνης, απαιτούνται όμως μεγαλύτερες πριν θεωρηθεί αποδεκτή θεραπεία της NASH.
Φαίνεται, λοιπόν, ότι τα φάρμακα που βελτιώνουν την ευαισθησία στην ινσουλίνη είναι υποσχόμενα στην αντιμετώπιση των ασθενών με μη αλκοολική στεατοηπατίτιδα. Ξεκάθαρα, όμως, χρειάζονται περισσότερες προοπτικές, συγκριτικές μελέτες με ικανό αριθμό ασθενών και μακρόχρονη παρακολούθηση για να τεκμηριωθούν η αποτελεσματικότητα και η ασφάλεια αυτών των φαρμάκων.
Τονίσθηκε ιδιαίτερα η σημασία του οξειδωτικού stress για τη δημιουργία της NASH. Οι αντιοξειδωτικές ιδιότητες της Βιταμίνης Ε προκύπτουν από την ευκολία να χορηγεί υδρογόνο που αδρανοποιεί τις ελεύθερες ρίζες και προλαβαίνει την υπεροξείδωση του λίπους. Η θεραπευτική αξία της βιταμίνης Ε δοκιμάζεται σε μεγάλη πολυκεντρική μελέτη.
Η βεταΐνη, ένας μεταβολίτης της χολίνης, δοκιμάζεται προς την ίδια κατεύθυνση. Επίσης, δοκιμάζεται η πεντοξυφιλλίνη, η οποία αναστέλλει τη δράση του TNF-a.
Από όλα τα φάρμακα που μελετώνται για τη θεραπεία της NAFLD, περισσότερο αποδεκτό φαίνεται να είναι το ουρσοδεοξυχολικό οξύ (UDCA), ένας κυτταροπροστατευτικός παράγοντας ο οποίος ασκεί τη δράση του μέσω της προστασίας και πρόληψης των βλαβών στις μεμβράνες. Το UDCA χορηγείται ήδη ως θεραπεία εκλογής σε άλλες χρόνιες ηπατοπάθειες, με πολύ καλά αποτελέσματα και χωρίς ιδιαίτερες παρενέργειες.
Με βάση όσα αναφέρθηκαν, οι οδηγίες σήμερα προς τους ασθενείς με NAFLD θα πρέπει να εστιάζονται κυρίως σε αλλαγή του τρόπου ζωής (δίαιτα, άσκηση), ενώ η χορήγηση φαρμάκων χρειάζεται να γίνεται με προσοχή και υπό συνεχή παρακολούθηση.
Abstract
Tsantoulas D, Chrisanthopoulou E. Non Alcoholic Fatty Liver Disease. Iatrika Analekta 2010, 3:280-284
Non-alcoholic fatty liver disease (NAFLD) is nowdays one of the most prevalent liver diseases. It covers a wide spectrum of liver pathology from simple steatosis, through the necroinflammatory disorder of non alcoholic steatohepatitis (NASH) to cirrhosis and possibly to hepatocellular carcinoma. NAFLD is strongly associated with obesity and insulin resistance. It is often detected in asymptomatic persons and when symptoms occur they are non-specific. Liver biopsy is the gold standard for the diagnosis of NASH and body weight reduction is the most important measure concerning the therapy.
Βιβλιογραφία
- American Gastroenterological Association. American Gastroenterological Association Medical Position Statement: Nonalcoholic Fatty Liver Disease. Gastroenterology 2002; 123:1.702 – 1.704.
- Angulo P. Nonalcoholic fatty liver disease. N Engl J Med 2002; 346:1.221.
- Angulo P, Hui JM, Marchesini G, et al. The NAFLD fibrosis score: A noninvasive system that identifies liver fibrosis in patients with NAFLD. Hepatology 2007 Apr; 45:846 – 854.
- Hossain N, Afendy A, Stepanova M, et al. Independent predictors of fibrosis in patients with nonalcoholic fatty liver disease. Clin Gastroenterol Hepatol. 2009 Nov; 7:1.224 – 1.229.
- Marchesini G, Bugianesi E, Forlani G, et al. Nonalcoholic fatty liver, steatohepatitis, and the metabolic syndrome. Hepatology 2003; 37:917 – 923.
- Marchesini G, Brizi M, Bianchi G, et al. Metformin in non-alcoholic steatohepatitis. Lancet 2001; 358:893 – 894.
- Promrat K, Lutchman G, Uwaifo GI, et al. A pilot study of pioglitazone treatment for nonalcoholic steatohepatitis. Hepatology 2004; 39:188 – 196.
- Sanyal AJ, Campbell-Sargent C, Mirshahi F. Nonalcoholic steatohepatitis: association of insulin resistance and mitochondrial abnormalities. Gastroenterology 2001; 120:1.183 – 1.192.
- Sanyal AJ. Review article: non-alcoholic fatty liver disease and hepatitis C – risk factors and clinical implications. Aliment Pharmacol. Ther. 2005; 22(Suppl. 2):48 – 51.
- Schwenzer NF, Springer F, Schraml C, et al. Non-invasive assessment and quantification of liver steatosis by ultrasound, computed tomography and magnetic resonance. J Hepatol. 2009; 51:433 – 445. Epub 2009 Jun 11.
- Wigg AJ, Roberts-Thomson IC, Dymock RB, et al. The role of small intestinal bacterial overgrowth, intestinal permeability, endotoxaemia, and tumour necrosis factor alpha in the pathogenesis of non-alcoholic steatohepatitis. Gut 2001; 48:206 – 211.
- Winn J, Poordad F. Review article: Diagnosis and treatment of non alcoholic fatty liver disease. Aliment Pharmacol. Ther. 2008; 28:503 – 522.
- Younossi ZM. Review article: Current management of non alcoholic fatty liver disease and non-alcoholic steatohepatitis. Aliment Pharmacol. Ther. 2008 28:2 – 12.
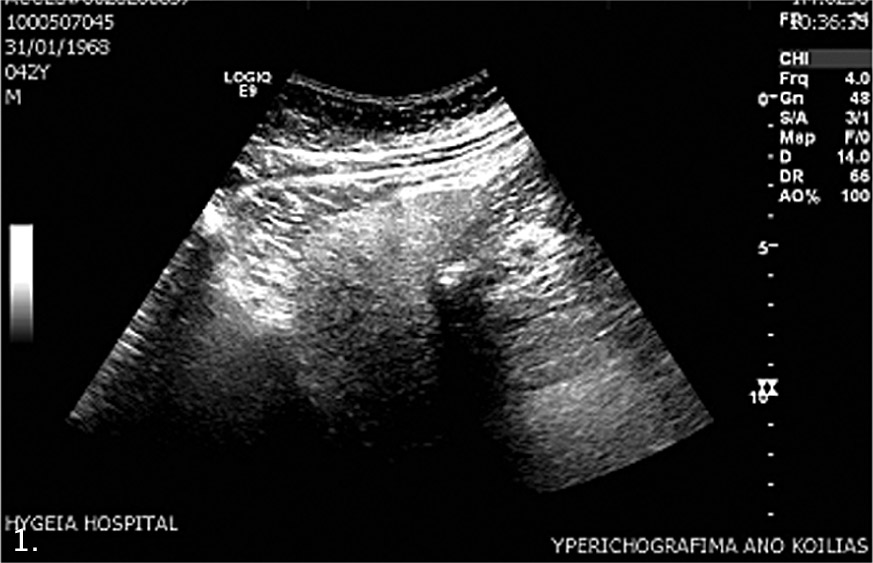
Εικ. 1. Υπερηχογράφημα ήπατος: ηπατική στεάτωση.
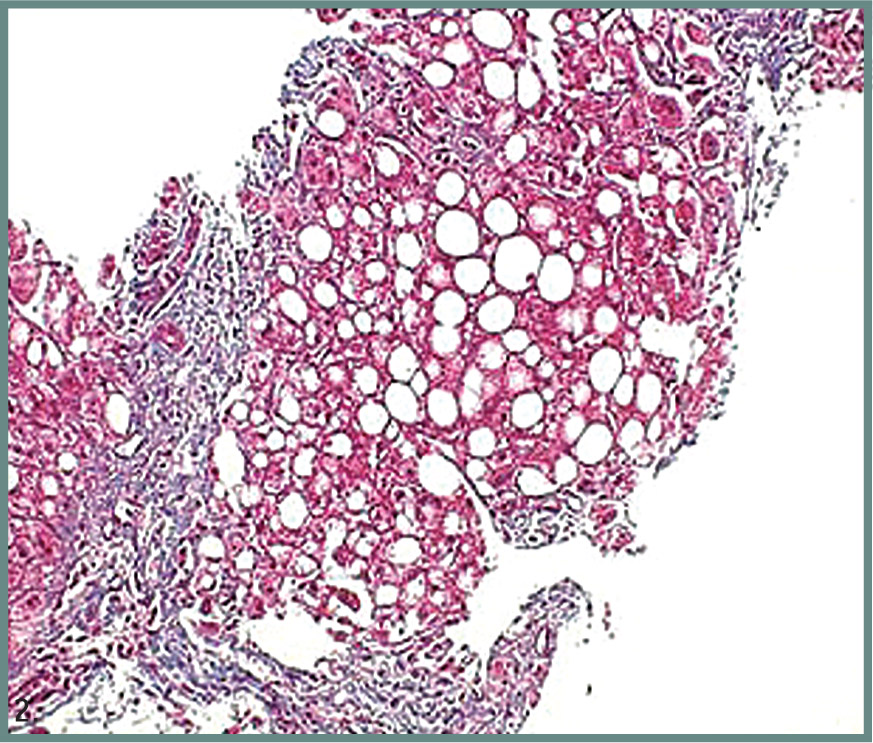
Εικ. 2. Βιοψία ήπατος: στεατοηπατίτιδα.
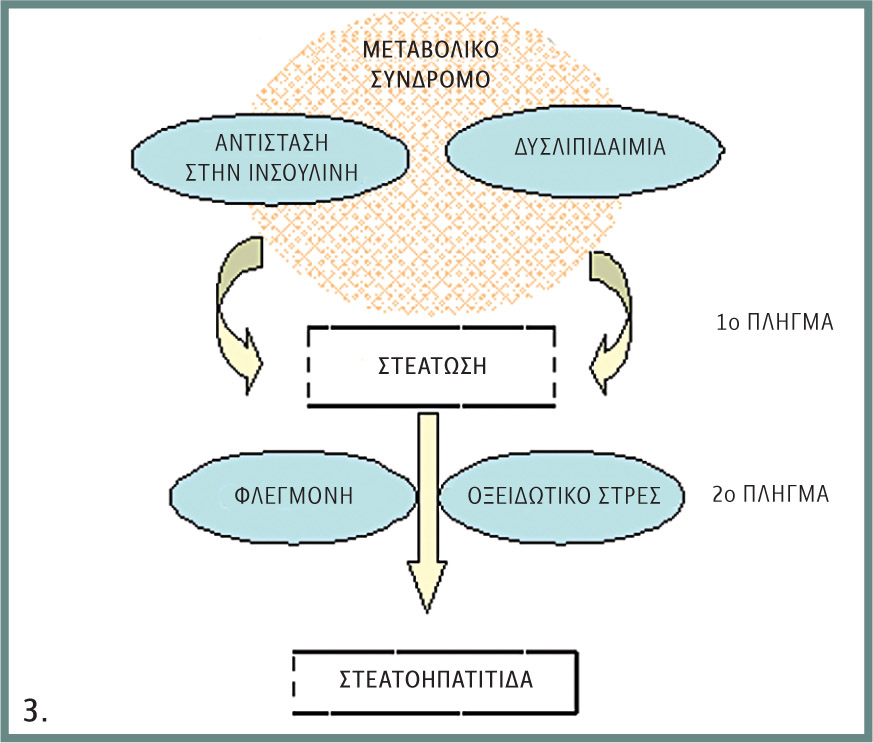
Εικ. 3. Παθογενετικός μηχανισμός.
Νοέμβριος 2010