Μοριακοί μηχανισμοί καρκινωματώδους εξαλλαγής ύστερα από λοίμωξη με ιό ανθρώπινου θηλώματος
Η λοίμωξη από τον ιό του ανθρώπινου θηλώματος (Human Papilloma Virus – HPV) είναι ένα από τα πιο συχνά σεξουαλικώς μεταδιδόμενα νοσήματα παγκοσμίως.
Γράφει ο
Εμμανουήλ Παπαδάκης
Παθολόγος, ΥΓΕΙΑ
Το γενετικό υλικό του HPV αποτελείται από δίκλωνο DNA και κωδικοποιεί σειρά πρώιμων ρυθμιστικών πρωτεϊνών (Early region: E6, E7, E1, E2, E4 και E5) και δύο δομικές πρωτεΐνες του καψιδίου (Late region: L1 και L2). Επίσης, περιλαμβάνει και μία ρυθμιστική περιοχή (Long Control Region – LCR). Μέχρι σήμερα έχουν τυποποιηθεί περίπου 130 διαφορετικοί τύποι HPV με βάση την αλληλουχία της μείζονος πρωτεΐνης του καψιδίου L1.
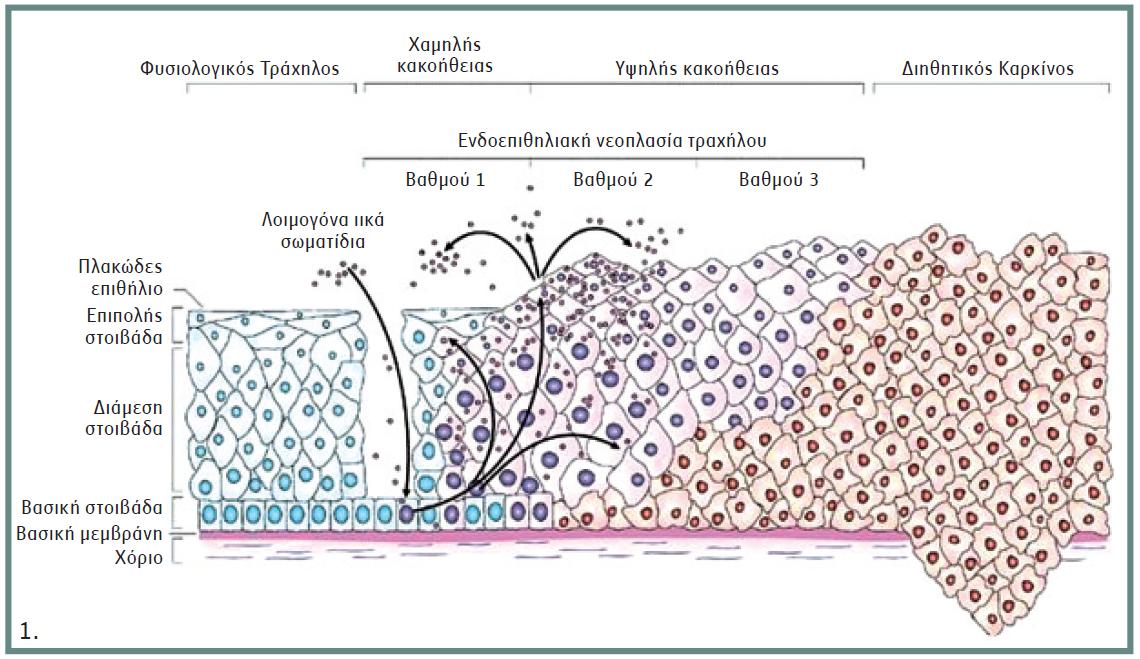
Λοίμωξη από σειρά τύπων HPV συνδέεται με την εμφάνιση καρκίνου του τραχήλου της μήτρας. Έτσι, οι λεγόμενοι τύποι υψηλού κινδύνου 16 και 18 απομονώνονται συχνότερα από περιπτώσεις καρκίνου του τραχήλου της μήτρας, απ’ ότι οι τύποι μέσου (31, 33, 35, 39, 45, 51, 52 και 58) και χαμηλού κινδύνου (6, 11, 42, 43 και 44). Ο τύπος 16 απομονώνεται στο 50% – 70% των περιπτώσεων και ο 18 στο 7% – 20% καρκίνου του τραχήλου της μήτρας. Ο ιός μολύνει αρχικά τα κύτταρα της βασικής στιβάδας του επιθηλίου, πιθανόν μέσω μικροδιαβρώσεων (εικόνα 1). Ωστόσο, όλες οι λοιμώξεις από τους τύπους 16 και 18 δεν εξελίσσονται σε καρκίνο.
Της εμφάνισης του καρκίνου προηγείται σειρά ανωμαλιών στο επιθήλιο του τραχήλου της μήτρας, από χαμηλού έως υψηλού κινδύνου κακοήθους εξαλλαγής (Cervical Intraepithelial Neoplasia – CIN 1 – 3). Η CIN 3 αποτελεί την υποχρεωτική πρόδρομη αλλοίωση για την εμφάνιση καρκίνου του τραχήλου της μήτρας και σε πάνω από το 90% των περιπτώσεων απομονώνεται ο HPV (εικόνα 1).
Ο HPV στο γονιδίωμά του περιλαμβάνει μόνο μία πρωτεΐνη με ιδιότητες DNA πολυμεράσης, την Ε1, και έτσι στηρίζεται σχεδόν αποκλειστικά στον βιοχημικό μηχανισμό του κυττάρου-ξενιστή για τον πολλαπλασιασμό του. Το πρόβλημα για τον HPV έγκειται στο ότι οι μηχανισμοί αντιγραφής του DNA ενεργοποιούνται μόνο σε μιτωτικώς ενεργά κύτταρα. Προκειμένου να υπερβεί αυτή τη δυσκολία ο HPV κωδικοποιεί πρωτεΐνες, όπως την Ε6 και την Ε7, που ενεργοποιούν τη σύνθεση του κυτταρικού DNA σε κύτταρα τα οποία δεν προορίζονται να εισέλθουν στον μιτωτικό κύκλο, ενώ παράλληλα αναστέλλουν την απόπτωση και καθυστερούν τη διαφοροποίηση του επιθηλιακού κυττάρου.
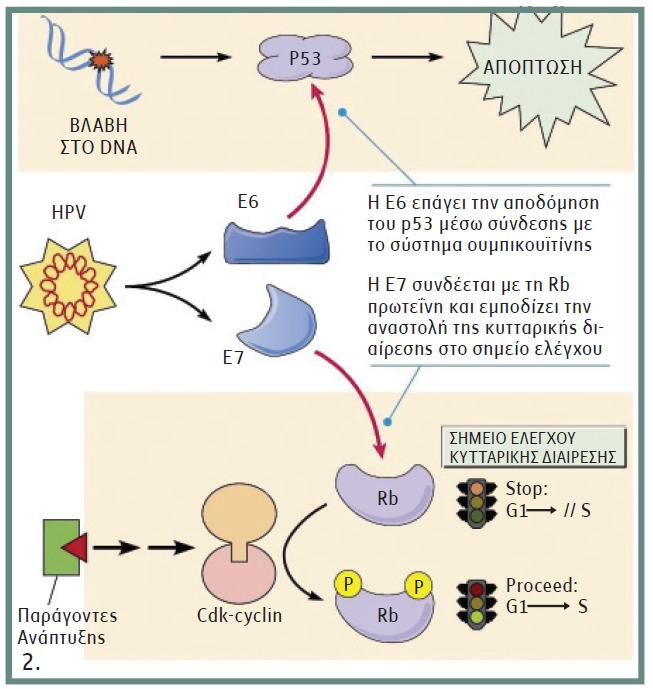
Το γονιδίωμα του HPV υπάρχει σε δύο μορφές: Συχνότερα εμφανίζεται σε κυκλική επισωματική μορφή που πολλαπλασιάζεται αυτόματα έξω από το χρωμόσωμα του κυττάρου-ξενιστή, αλλά εντός του πυρήνα. Σε μερικές περιπτώσεις (π.χ. CIN 3) η επισωματική μορφή γίνεται γραμμική και ενσωματώνεται στο DNA του ξενιστή, συνήθως μεταξύ των γονιδίων Ε1 και Ε2 (βέλος στην εικόνα 2). Αυτό οδηγεί στην υπερέκφραση των Ε6 και Ε7 πρωτεϊνών, λόγω απώλειας της κατασταλτικής επίδρασης της Ε2.
Η Ε6 πρωτεΐνη ασκεί την ογκογόνο δράση της μέσω σύνδεσης με την p53 πρωτεΐνη. Στο φυσιολογικό κύτταρο η p53 πρωτεΐνη είναι ένα είδος μοριακού χωροφύλακα, που εμποδίζει τον κυτταρικό πολλαπλασιασμό σε περιπτώσεις όπου έχουν συσσωρευτεί σημαντικές χρωμοσωμικές αλλοιώσεις, δίνοντας χρόνο στους επιδιορθωτικούς μηχανισμούς του κυττάρου να δράσουν. Σε περίπτωση που η βλάβη δεν είναι επιδιορθώσιμη, το κύτταρο οδηγείται στην απόπτωση. Ύστερα από τη σύνδεσή της με την Ε6, με τη βοήθεια της Ε6AP, η p53 αποδομείται μέσω του μηχανισμού της ουμπικουιτίνης, οδηγώντας έτσι σε ανεξέλεγκτο κυτταρικό πολλαπλασιασμό, με παράλληλη συσσώρευση γενετικών αλλοιώσεων χωρίς επιδιόρθωση (εικόνα 2).
Η Ε7 πρωτεΐνη συνδέεται με την Rb πρωτεΐνη (πρωτεΐνη ρετινοβλαστώματος), απελευθερώνοντας τον E2F μεταγραφικό παράγοντα και επιτρέπει έτσι σε κύτταρα με βλάβη στο DNA να παρακάμψουν την G1 φάση του κυτταρικού κύκλου και την αναστολή που επάγεται από το p53 (εικόνα 2). Η Ε7 πρωτεΐνη ευνοεί επίσης την απόπτωση σε κύτταρα που φέρουν φυσιολογική p53 πρωτεΐνη, ενώ σε κύτταρα με μεταλλαγμένη p53 πρωτεΐνη ασκεί αντιαποπτωτική δράση, γεγονός εξίσου σημαντικό προς την κακοήθη εξαλλαγή.
Η κατάργηση των μηχανισμών ελέγχου του πολλαπλασιασμού, πέρα από τη συνεχή συσσώρευση αλλοιώσεων στο γενετικό υλικό, δεν μπορεί να εξηγήσει και την έκφραση του κακοήθους φαινοτύπου από τα κύτταρα. Φαίνεται πως υπάρχουν και άλλα γεγονότα τα οποία προς το παρόν δεν είναι απόλυτα διευκρινισμένα, όπως η απώλεια του διακυτταρικού ελέγχου μέσω κυτταροκινών, π.χ. IFNa και TNFa. Επίσης, έχει προταθεί ότι οι συγκεκριμένοι πολυμορφισμοί του p53 (ομόζυγοι αργινίνης στο κωδικόνιο 72) καθιστούν την πρωτεΐνη περισσότερο ευάλωτη στην αποδόμησή της, μετά τη σύνδεση με την Ε6 πρωτεΐνη του ιού.
Ανεξάρτητα από τον παθοφυσιολογικό μηχανισμό της κακοήθους εξαλλαγής, η ευρεία εφαρμογή του τετραδύναμου εμβολίου (περιλαμβάνει τους τύπους 6, 11, 16 και 18) πιθανόν να οδηγήσει σε ριζική μεταβολή της επιδημιολογίας τόσο της λοίμωξης όσο και των μορφών καρκίνου που συνδέονται με τον HPV.
Εικ. 1. Σχηματική παράσταση της εξέλιξης της HPV λοίμωξης σε καρκίνο του τραχήλου της μήτρας. Τροποποιημένο από 1.
Εικ. 2. Μοριακοί μηχανισμοί που συμβάλλουν στο ογκογόνο δυναμικό του HPV. Τροποποιημένο από τη διεύθυνση στο Διαδίκτυο: http://www.mun.ca/biology/desmid/brian/BIOL2060/BIOL2060-24/CB24.html.
Ιανουάριος 2010





































