Οξέα στεφανιαία σύνδρομα
Στον αναπτυγμένο κόσμο τα καρδιαγγειακά νοσήματα αποτελούν την πρώτη αιτία θανάτου. Στις ΗΠΑ οι καρδιαγγειακοί θάνατοι υπολογίζονται στο 30% του συνόλου, ενώ οι εισαγωγές στα νοσοκομεία ανέρχονται περίπου σε 2 εκατομ. το χρόνο1.H αθηρωμάτωση των στεφανιαίων αποτελεί την κύρια αιτία στο 75% των οξέων στεφανιαίων συνδρόμων(ΟΣΣ).
Γράφει ο
Σωτήρης X. Καλιαμπάκος
Καρδιολόγος
Σύμφωνα με τα σημερινά δεδομένα τα ΟΣΣ περιλαμβάνουν:1)το οξύ έμφραγμα του μυοκαρδίου με ανάσπαση του ST διαστήματος (STEMI), 2) χωρίς ανάσπαση του ST (NSTEMI) και 3) την ασταθή στηθάγχη. Η κατάταξη αυτή χαρακτηρίζεται από δύο κυρίως στοιχεία: από την ύπαρξη ή όχι ανάσπασης του ST στο ηλεκτροκαρδιογράφημα (ΗΚΓ) και από την ανίχνευση τυχόν μυοκαρδιακής βλάβης (κυρίως με τις τροπονίνες T και I και τα ένζυμα CPK, CPK-MB, SGOT, LDH ). Αναιρείται ο προηγούμενος διαχωρισμός σε Q και non-Q εμφράγματα, δεδομένου ότι συχνά τα STEMI δεν εξελίσσονται σε Q εμφράγματα και τα NSTEMI δύνανται να εξελιχθούν σε Q εμφράγματα του μυοκαρδίου.
Βασικό ρόλο στην παθοφυσιολογία των ΟΣΣ διαδραματίζουν το ενδοθήλιο και η αθηρωματική πλάκα. Το ενδοθήλιο αποτελεί την εσωτερική επένδυση των αγγείων και είναι ενδοκρινές όργανο που παράγει πλήθος ουσιών. Η ισορροπία των προθρομβωτικών και αντιθρομβωτικών παραγόντων που παράγει είναι απαραίτητη προϋπόθεση για τη σωστή λειτουργία του. Η δυσλειτουργία του ενδοθηλίου παίζει πρωτεύοντα ρόλο στην παθογένεια πολλών νοσημάτων. Στο μηχανισμό της αθηροθρόμβωσης συμμετέχουν αλληλένδετα η λειτουργία του ενδοθηλίου, τα αιμοπετάλια και οι πρωτεΐνες του πλάσματος(οι παράγοντες πήξης και ινωδόλυσης) (εικ.1) 2
Η μελέτη των μηχανισμών δημιουργίας, εξέλιξης, διάβρωσης και ρήξης της αθηρωματικής πλάκας αποτελεί προϋπόθεση για την κατανόηση της παθοφυσιολογίας και κυρίως της θεραπευτικής αντιμετώπισης των ΟΣΣ. Τα βασικά συστατικά της αθηρωματικής πλάκας είναι ο λιπώδης πυρήνας και η ινώδης κάψα. Σύμφωνα με τη θεωρία της αθηρωματικής πλάκας υπάρχουν τα εξής στάδια από τη δημιουργία μέχρι τη διάβρωση και την τελική ρήξη, η οποία με την επακόλουθη θρομβωτική απόφραξη προκαλεί το οξύ στεφανιαίο σύνδρομο.(εικ.2)2 Το πρώτο στάδιο χαρακτηρίζεται από την τοπική συσσώρευση, διαφοροποίηση και οξείδωση των μορίων LDL-χοληστερόλης στο ενδοθήλιο ως «απάντηση» σε διαφόρων ειδών τραυματισμούς (μηχανικούς, ανοσολογικούς, τοξικούς, ιογενείς ) Στη συνέχεια το οξειδωτικό stress προκαλεί τοπική έκλυση κυτοκινών. (στάδιο 2). Οι κυτοκίνες ευνοούν τη συσσώρευση μονοκυττάρων στον έξω χιτώνα του αγγειακού τοιχώματος (στάδιο 3). Η είσοδος των μονοκυττάρων στο αγγειακό τοίχωμα ευνοείται κυρίως από τη δράση της κυτοκίνης MCP-1,προκαλώντας την ενεργοποίηση του παράγοντα MCSF που συνδέεται με τη λειτουργία των υποδοχέων Scavenger (στάδιο 4). Οι υποδοχείς αυτοί συμβάλλουν στην πρόσληψη των τροποποιημένων μορίων LDL χοληστερόλης και στο σχηματισμό του λιπώδη πυρήνα της αθηρωματικής πλάκας (στάδιο 5).Το έκτο στάδιο χαρακτηρίζεται από τη μετανάστευση των λείων μυϊκών κυττάρων στον έσω χιτώνα των αρτηριών. Με το σχηματισμό της ινώδους κάψας η πλάκα λαμβάνει την τελική της μορφή (στάδιο 7). Στο επόμενο και τελευταίο στάδιο είναι δυνατόν να αναπτυχθούν διαδικασίες ασβέστωσης, ίνωσης και τελικά απόπτωσης.
Η στεφανιαία αθηροθρόμβωση προκαλεί το 75% των ΟΣΣ. Άλλες αιτίες είναι: η εμβολή των στεφανιαίων αρτηριών (από ενδοκαρδίτιδα, προσθετικές βαλβίδες, μύξωμα ή κατα την διάρκεια της στεφανιαίας παράκαμψης και στεφανιογραφίας), συγγενείς ανωμαλίες των στεφανιαίων αρτηριών, αιματολογικές νόσοι (in situ θρόμβωση), αρτηρίτιδες (πολυαρτηρίτιδα, ν.Takayasou, σ.Kawasaki, αγκυλοποιητική σπονδυλίτιδα), τραύματα των στεφανιαίων, χρήση κοκαΐνης ή στεφανιαίες στενώσεις που προκύπτουν από άλλους μηχανισμούς, πλην της αθηροθρόμβωσης (σπασμός, διαχωρισμός αορτής ή στεφανιαίας αρτηρίας).
ΕΜ με ανάσπαση του ST (STEMI)
Η νοσοκομειακή θνητότητα του ΟΕΜ έχει μειωθεί κατά 30% την τελευταία δεκαετία. Ιστορικά αναφέρεται ότι η ευρεία λειτουργία των μονάδων εντατικής θεραπείας συνέβαλε στην υποχώρηση της θνητότητας από το 30% στο 15%, η θρομβόλυση αύξησε τη μείωση στο 6,5%, ενώ η πρωτογενής αγγειοπλαστική περίπου στο 5%. Υπολογίζεται ότι περίπου το 50% των ασθενών με οξύ έμφραγμα του μυοκαρδίου δεν προσέρχονται στο νοσοκομείο λόγω αιφνίδιου θανάτου εξ’αιτίας πρώιμων αρρυθμιών(κοιλιακή μαρμαρυγή, πλήρης κολποκοιλιακός αποκλεισμός).
Η παθογένεια του STEMI περιλαμβάνει τη ρήξη της αθηρωματικής πλάκας, την ενεργοποίηση του μηχανισμού πήξης, το σχηματισμό θρόμβου και την επακόλουθη ολική απόφραξη του στεφανιαίου αγγείου. Η διαδικασία μετάπτωσης από τη χρόνια στεφανιαία νόσο στο οξύ ισχαιμικό σύνδρομο, αποτελεί αντικείμενο συνεχιζόμενης μελέτης.
Η οξεία μεταβολή της πλάκας δεν σχετίζεται με το βαθμό της στένωσης που προκαλεί στον αυλό του στεφανιαίου αγγείου, αλλά με τη σύνθεσή της. Η σχέση λιπώδους πυρήνα και ινώδους κάψας παίζει σημαντικό ρόλο στη δημιουργία των ΟΣΣ. Τον τραυματισμό του ενδοθηλίου στην επιφάνεια της πλάκας ακολουθεί η διαδικασία ενεργοποίησης, προσκόλλησης και συσσώρευσης των αιμοπεταλίων. Στη συνέχεια η έκλυση αγγειοσυσπαστικών παραγόντων από το ενδοθήλιο (κατά κύριο λόγο θρομβοξάνης Α2, σεροτονίνης, ADP, θρομβίνης, παράγοντα TNF) σε βάρος των αγγειοδιασταλτικών παραγόντων (EDRF, PGL2, T-PA) έχει ως τελικό αποτέλεσμα την αγγειοσύσπαση και θρόμβωση3,4.
Παράγοντες που επιδρούν στη διάβρωση και ρήξη της πλάκας είναι: η παραγωγή μεταλλοπρωτεϊνασών (κολλαγενάση, στρομελυσίνη, ζελατινάση) από τα ενεργοποιημένα μακροφάγα, η συστολική, κυρίως, αρτηριακή πίεση, η καρδιακή συχνότητα, το ιξώδες του πλάσματος, η ενεργοποίηση του t-PA και τα επίπεδα του PAI-1, της κορτιζόλης και της επινεφρίνης του πλάσματος. Τέλος αξίζει να σημειωθεί η κιρκάδια και η εποχιακή διακύμανση στην επίπτωση των ΟΣΣ.
Υπολογίζεται ότι στο 75% των ΟΕΜ υπάρχει νόσος σε περισσότερα από ένα στεφανιαία αγγεία ,στο 1/3 έως τα 2/3 υπάρχει νόσος τριών αγγείων, ενώ τα ΟΣΣ προκαλούνται συχνά από μη σημαντικές στενώσεις (<70%). Αυτό συμβαίνει διότι η σημαντική μείωση του αυλού προκαλεί συνήθως πλούσιο παράπλευρο δίκτυο. Ο αριθμός των μη κριτικών στενώσεων είναι αρκετά μεγαλύτερος, ενώ υπενθυμίζεται ότι το ΟΣΣ προκαλείται από τη θρομβωτική απόφραξη και όχι από τη στένωση αυτή καθεαυτή.
Η σύσταση του θρόμβου χαρακτηρίζει το είδος του ΟΣΣ. Έτσι, ο θρόμβος, πλούσιος σε ινική είναι συνήθως υπεύθυνος για τα STEMI ενώ ο θρόμβος των NSTEMI είναι κυρίως αιμοπεταλιακός. Αυτό εξηγεί και τη διαφοροποίηση στη θεραπευτική αντιμετώπιση έχοντας βασικό όπλο τη θρομβόλυση (ινωδόλυση) στα ΟΕΜ με ανάσπαση του ST και τα αντιαιμοπεταλιακά φάρμακα στα NSTEMI.
Οι κύριες παθοφυσιολογικές διαταραχές στο ΟΕΜ αφορούν στη συστολική και διαστολική λειτουργία του μυοκαρδίου, την αναδιαμόρφωση της αριστερής κοιλίας, τη γενικότερη προσαρμογή της κυκλοφορίας και την επίπτωση στη λειτουργία άλλων περιφερικών οργάνων.
Η συστολική δυσλειτουργία εκφράζεται στο μεν «πάσχον» μυοκάρδιο ως διαταραχή της κινητικότητας και ανάλογα με τη βαρύτητα ως υποκινησία, ακινησία ή δυσκινησία, ενώ στο υγιές μυοκάρδιο είτε ως υπερκινησία (λόγω δράσης του συμπαθητικού νευρικού συστήματος και του νόμου Frank Starling) είτε ως υποκινησία (λόγω μειωμένης παράπλευρης κυκλοφορίας ή συνυπάρχουσας στεφανιαίας νόσου). Αιμοδυναμικά η δυσλειτουργία αυτή εκφράζεται με μείωση του όγκου παλμού, της καρδιακής παροχής, υπόταση, συστηματική υπάρδευση, ελάττωση της στεφανιαίας εφεδρείας και κατ’ επέκταση υποτροπή της ισχαιμίας.
Η διαστολική δυσλειτουργία είναι αποτέλεσμα μείωσης της ενδοτικότητας της αριστερής κοιλίας (αύξησης της ανελαστικότητας). Εκφράζεται με αύξηση της τελοδιαστολικής της πίεσης και μεταφορά των αυξημένων πιέσεων προς τα πνευμονικά τριχοειδή (πνευμονική συμφόρηση). Η προκαλούμενη υποξία ανατροφοδοτεί το φαύλο κύκλο της ισχαιμίας.
Οι παραπάνω διαταραχές έχουν άμεση σχέση με την έκταση του εμφράγματος. Σημεία διαστολικής καρδιακής ανεπάρκειας εκδηλώνονται όταν η εμφραγματική περιοχή καταλαμβάνει το 8% της αριστερής κοιλίας, συστολική δυσλειτουργία όταν πάσχει το 25% αυτής, εκδηλώσεις συμφορητικής καρδιακής ανεπάρκειας σε απώλεια του 40% του κοιλιακού μυοκαρδίου και εικόνα καρδιογενούς shock σε εκτεταμένα ΟΕΜ (>45% της αριστερής κοιλίας).
Κεντρική σημασία στη μεσοπρόθεσμη και μακροπρόθεσμη πρόγνωση του ΟΕΜ κατέχει η κοιλιακή αναδιαμόρφωση. Χαρακτηρίζεται από λέπτυνση και διάταση του εμφραγματικού τοιχώματος καθώς και από υπερτροφία του υγιούς τμήματος της αριστερής κοιλίας και τελικά τη διάταση της.
Σύμφωνα με τα κριτήρια της Παγκόσμιας Οργάνωσης Υγείας για να τεθεί η διάγνωση του ΟΣΣ απαιτούνται τουλάχιστον δύο από τις παρακάτω τρεις προϋποθέσεις: ισχαιμικού τύπου προκάρδια δυσφορία, ηλεκτροκαρδιογραφικές αλοιώσεις ισχαιμίας μυοκαρδίου και εργαστηριακή ανίχνευση δεικτών μυοκαρδιακής νέκρωσης. Οι δείκτες αφορούν στην ισομορφή ΜΒ της κρεατινικής φωσφοκινάσης CPK ( η οποία εκτός από το μυοκάρδιο εκλύεται από τη γλώσσα ,το έντερο ,το διάφραγμα ,τη μήτρα και τον προστάτη) και τις καρδιακές τροπονίνες.(TnT, TnI)5 .Η μέτρηση των τροπονινών υπερέχει του CK-MB στα εξής: εμφανίζει μεγαλύτερη ειδικότητα στη διάγνωση του ΟΣΣ, ανιχνεύει καλύτερα τη μικρή μυοκαρδιακή βλάβη και την υποτροπή της ισχαιμίας, ενώ αποτελεί ανεξάρτητο παράγοντα κινδύνου για νέα καρδιαγγειακά συμβάματα.
Έμφραγμα χωρίς ανάσπαση του ST-Ασταθής στηθάγχη (NSTEMI-UA)
Παρ’ ότι η κλινική έρευνα εστιάζεται κυρίως στα STEMI, η συχνότητα των UA/NSTEMI είναι πιο μεγάλη και οι εισαγωγές στα νοσοκομεία των ΗΠΑ υπολογίζονται σε 350000 και 1,3 εκατομμύρια το χρόνο αντίστοιχα.
Η ασταθής στηθάγχη στοιχειοθετείται κλινικά αν υπάρχει μία από τις παρακάτω προϋποθέσεις: στηθάγχη ηρεμίας ,πρόσφατη (διάρκεια μικρότερη του μηνός)έναρξη στηθάγχης προσπαθείας, επιδείνωση γνωστής στηθάγχης προσπαθείας σε συνδυασμό με ισχαιμικού τύπου αλλοιώσεις στο ΗΚΓ. Αν συνυπάρχουν θετικοί δείκτες μυοκαρδιακής νέκρωσης πρόκειται για NSTEMI.
Η κατάταξη ασταθούς στηθάγχης κατά Braunwald καθορίζεται με κλινικά κριτήρια και σχετίζεται με την ετήσια πρόγνωση. Η κατηγορία Ι αφορά τη νέα εμφάνιση στηθάγχης ή την επιδείνωση γνωστής στηθάγχης χωρίς επεισόδια στην ηρεμία (7,3% πιθανότητα ΟΕΜ ή θανάτου τον πρώτο χρόνο), η κατηγορία ΙΙ, στηθάγχη ηρεμίας τον τελευταίο μήνα αλλά όχι τις τελευταίες 48 ώρες (αντίστοιχος κίνδυνος 10,3%) και η κατηγορία ΙΙΙ, στηθάγχη ηρεμίας τις τελευταίες 48 ώρες (10,8 %).
Πέντε αιτιολογικοί μηχανισμοί δύνανται να συμμετέχουν στην παθοφυσιολογία των UA/NSTEMI. Η μηχανική απόφραξη (κλινικά σημαντική στεφανιαία αθηρωμάτωση), η δυναμική απόφραξη (σπασμός επί συνυπάρχουσας ή όχι σημαντικής στένωσης), η θρόμβωση, η φλεγμονή-λοίμωξη και η αυξημένη μυοκαρδιακή κατανάλωση οξυγόνου. Παράγοντες αυξημένου κινδύνου για διάβρωση-ρήξη της αθηρωματικής πλάκας αποτελούν: η αύξηση του λιπώδους πυρήνα, η λεπτή και ευάλωτη ινώδης κάψα και βέβαια η ανεξάρτητα αιτίας ενεργοποίηση του μηχανισμού πήξης και των αιμοπεταλίων.
Ενδείξεις αυξημένου κινδύνου προκύπτουν από το ιστορικό των ασθενών με UA/NSTEMI6.Ηλικία άνω των 65 ετών, η συνύπαρξη σακχαρώδη διαβήτη και περιφερικής αγγειακής νόσου και το ιστορικό αγγειακού εγκεφαλικού επεισοδίου. Από την κλινική εικόνα δείκτες κακής πρόγνωσης αποτελούν οι κατηγορίες II και III κατά την ταξινόμηση Braunwald καθώς και η μετεμφραγματική στηθάγχη, τα σημεία καρδιακής ανεπάρκειας και η συμπτωματική υπόταση. Από το ΗΚΓ ο αποκλεισμός αριστερού σκέλους και οι επιμένουσες ισχαιμικού τύπου μεταβολές (ιδιαίτερα στο «ασυμπτωματικό» ΗΚΓ ηρεμίας). Από τον εργαστηριακό έλεγχο ξεχωρίζουν η επιμένουσα αύξηση των δεικτών μυοκαρδιακής νέκρωσης και της CRP, ενώ από τον αγγειογραφικό έλεγχο δείκτες αυξημένου κινδύνου αποτελούν η πολυαγγειακή στεφανιαία νόσος και η απεικόνιση ενδοστεφανιαίου θρόμβου.
Συμπερασματικά, τα οξέα στεφανιαία σύνδρομα, παρά τις επιμέρους διαφορές στην παθογένεια και τη θεραπευτική αντιμετώπιση, αποτελούν σήμερα ενιαία παθολογική οντότητα με βασικό στοιχείο τη διαδικασία της αθηροθρόμβωσης, η οποία συμμετέχει σε πλήθος καρδιαγγειακών νόσων.
Βιβλιογραφία
1. American Heart Association: 1999 Heart and Stroke Statistical Update. Dallas, American Heart Association.1999
2. Libby B. The Vascular Biology of Atherosclerosis,in Braunwald, Zipes, Libby, Heart Disease 6th edition, W.B Saunders Company, 2001 p. 1006
3.Malek et al:Hemodynamic shear stress and its role in atherosclerosis. JAMA 1999; 282:2035-2042.
4.Dahlback B: Blood coagulation. Lancet 2000; 355:1627-32.
5.Panteghini M et al: Use of biochemical markers in acute coronary syndromes. IFCC Scientific Division, Committee on Standardization of Markers of Cardiac Damage, International Federation of Clinical Chemistry. Clin Chem Lab Med 1999; 37:687-693.
6.Zimmerman J et al: Diagnostic marker cooperative study for the diagnosis of myocardial infarction. Circulation 2000; 99:1671-1677.
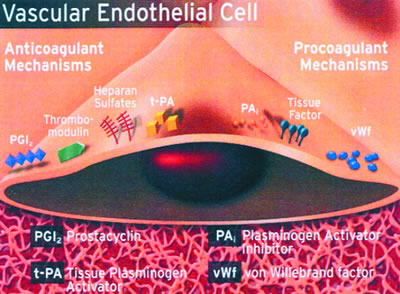
Εικ. 1: Σχηματική παράσταση της λειτουργίας του ενδοθηλίου
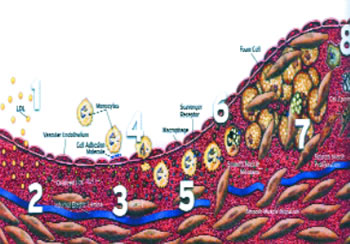
Εικ. 2: Στάδια εξέλιξης της αθηρωματικής πλάκας
Ιούνιος 2007






































