Σύνδρομο εύθραυστου Χ και νοητική υστέρηση: μεθοδολογία προσέγγισης και μοριακή διάγνωση
Το σύνδρομο του εύθραυστου Χ χρωμοσώματος (fragile X syndrome – FXS-OMIM 300624) είναι η συχνότερη μορφή μονογονιδιακής κληρονομούμενης νοητικής υστέρησης (1/3.600-1/4.000 αγόρια και 1/6.000-1/8.000 κορίτσια) και η δεύτερη συχνότερη αιτία νοητικής υστέρησης μετά το σύνδρομο Down, όπως επίσης και μία από τις σημαντικότερες αιτίες αυτισμού.
Γράφουν οι
Δήμητρα Μπουζαρέλου
Στέλλα Αμέντα
Τμήμα Γενετικής και Μοριακής Βιολογίας ΜΗΤΕΡΑ
Αγγελική Χατζάκη
Παιδιατρική Κλινική ΜΗΤΕΡΑ
Είναι μονογονιδιακό φυλοσύνδετο νόσημα και το υπεύθυνο γονίδιο (FMR-1) εδράζεται στο χρωμόσωμα Χ. Αποτελεί ένα από τα σύνδρομα επέκτασης τρινουκλεοτιδίων και οφείλεται στην επανάληψη μιας τριπλέτας νουκλεοτιδίων κυτοσίνης – γουανίνης – γουανίνης (CGG) που εντοπίζεται στην 5΄-αμετάφραστη περιοχή του γονιδίου FMR-1 που εδράζεται στην περιοχή q27.3 του χρωμοσώματος Χ (σχήμα 1).
Σε φυσιολογικά άτομα (normal alleles) ο αριθμός των επαναλήψεων CGG κυμαίνεται μεταξύ 5-50, σε φορείς προμετάλλαξης (premutation alleles) μεταξύ 55-200 και σε πάσχοντα άτομα (full mutation alleles) >200 φορές. Τα άτομα που φέρουν 50-54 επαναλήψεις θεωρείται ότι ανήκουν στην γκρίζα ζώνη (intermediate alleles). Άρρενα (ΧΥ) και θήλεα (ΧΧ) άτομα είναι εξίσου πιθανό να είναι φορείς της προμετάλλαξης ή πάσχοντες. Οι πατέρες-φορείς προμετάλλαξης κληρονομούν υποχρεωτικά στις κόρες τους το παθολογικό Χ χρωμόσωμα και κατά συνέπεια όλες είναι φορείς προμετάλλαξης και έχουν πιθανότητα 50% να μεταβιβάσουν το παθολογικό χρωμόσωμα Χ στα άρρενα ή θήλεα τέκνα τους.
Όμως, αν και η νόσος κληρονομείται με τον επικρατή χαρακτήρα, εμφανίζει δύο χαρακτηριστικά που τροποποιούν τη μενδελική μεταβίβαση: μειωμένη διεισδυτικότητα και το φαινόμενο της επίσπευσης. Το παραπάνω σημαίνει ότι το παθολογικό FMR-1 γονίδιο μπορεί είτε να μεταβιβαστεί αμετάβλητο ως αλληλόμορφο προμετάλλαξης είτε να επεκταθεί σε αλληλόμορφο πλήρους μετάλλαξης, και η πιθανότητα να συμβεί αυτό αυξάνεται σε διαδοχικές γενιές (επίσπευση). Η επέκταση σε >200 τριπλέτες έχει ως αποτέλεσμα τη μεθυλίωση των κυτοσινών, άρα και απενεργοποίηση του γονιδίου FMR-1 και τη μειωμένη ή μηδενική παραγωγή της κωδικοποιούμενης FMR πρωτεΐνης (FMRP). Τα θήλεα άτομα με πλήρη μετάλλαξη στο γονίδιο FMR1 συνήθως εμφανίζουν ηπιότερη την εικόνα του συνδρόμου από τα άρρενα και αυτό οφείλεται κυρίως στο φαινόμενο της τυχαίας απενεργοποίησης του Χ χρωμοσώματος (μειωμένη διεισδυτικότητα).
Κατά συνέπεια, αν και όλες οι μητέρες πασχόντων αρρένων είναι υποχρεωτικά φορείς της μετάλλαξης ή της προμετάλλαξης, περίπου το 70% δεν εμφανίζει καμιάς μορφής νοητική υστέρηση.
Η πρωτεΐνη FMRP
Η πρωτεΐνη FMRP είναι μία RNA-binding πρωτεΐνη που συμμετέχει στην αρνητική ρύθμιση της πρωτεϊνοσύνθεσης και εκφράζεται κυρίως σε ιστούς του εγκεφάλου και των όρχεων. Μελέτες που διεξήχθησαν από το 1993 και μετά υποστηρίζουν την υπόθεση ότι η πρωτεΐνη FMRP λειτουργεί και ως μεταφραστικός καταστολέας συγκεκριμένων mRNAs που αποτελούν τους στόχους της και ως ρυθμιστής της μεταφοράς και εντοπισμού αυτών των mRNAs σε δενδριτικά κύτταρα και συνάψεις.
Τα ευρήματα αυτά ενισχύουν την υπόθεση ότι η πρωτεϊνη FMRP παίζει σημαντικό ρόλο στην εγκεφαλική λειτουργία, που σχετίζεται με τη λειτουργία των συνάψεων, την ωρίμανση και την πλαστικότητά τους και ότι η απώλεια έκφρασης της FMRP πιθανόν να οδηγεί σε ανώμαλη δομή και λειτουργία των συνάψεων.
Επιπλέον, πειράματα που διεξήχθησαν από το 2002 και μετά ενισχύουν και μια δεύτερη υπόθεση για τη λειτουργία της FMRP. Η υπόθεση αυτή συνδέεται με τη λειτουργία των μεταβολοτροπικών υποδοχέων του νευροδιαβιβαστή γλουταμινικό οξύ (mGluR), από τη στιγμή όπου διαπιστώθηκε ότι μία από τις συνέπειες της ενεργοποίησης των υποδοχέων αυτών είναι η αύξηση της πρωτεϊνοσύνθεσης στις συνάψεις. Σε in vivo πειράματα σε ποντίκια, στα οποία είχε απενεργοποιηθεί το γονίδιο FMR-1, η προσθήκη ενός ανταγωνιστή των mGluRs στα συναπτονευρωνικά κυστίδια οδήγησε σε σύνθεση της FMRP. Αυτό αποτέλεσε ένα σημαντικό βήμα και στη διαλεύκανση του υπεύθυνου μηχανισμού που ευθύνεται για το σύνδρομο εύθραυστου Χ, αλλά κυρίως έδωσε δύο σημαντικές πληροφορίες.
Η πρώτη ήταν ότι και άλλες συνέπειες της ενεργοποίησης των mGluRs μπορεί να τροποποιούνται όταν λείπει η FMRP πρωτεΐνη. Η δεύτερη και σημαντικότερη ήταν ότι η μείωση της δραστικότητας των mGluRs μπορεί να αποκαταστήσει τη φυσιολογική πρωτεϊνοσύνθεση στις συνάψεις των ατόμων με απουσία της FMRP και έτσι να ανατρέψει εν μέρει τον παθολογικό φαινότυπο των ατόμων με σύνδρομο εύθραυστου Χ.
Έτσι, τίθεται ένας πρώτος CθεραπευτικόςE στόχος στα πάσχοντα άτομα, που δεν βασίζεται σε αυτήν καθεαυτήν τη γονιδιακή θεραπεία, δηλαδή στην αποκατάσταση της φυσιολογικής FMRP.
Κλινική εικόνα
Κλινική υποψία τίθεται στα αγόρια με μέτρια έως σοβαρή νοητική υστέρηση. Στα κορίτσια ο φαινότυπος είναι ηπιότερος λόγω του φαινομένου της τυχαίας απενεργοποίησης του Χ χρωμοσώματος και του κυτταρικού μωσαϊκισμού που προκύπτει, αν και έχει περιγραφεί στη βιβλιογραφία πάσχουσα γυναίκα στην οποία είχε απενεργοποιηθεί τελείως το φυσιολογικό Χ.
Τα αγόρια εμφανίζουν μακροκεφαλία, επιμηκυσμένο πρόσωπο, μεγάλα αφτιά και προεξέχουσα γνάθο. Ενίοτε συνυπάρχει υπερεκτασιμότητα αρθρώσεων. Στον καρδιολογικό έλεγχο ευρίσκεται συχνά ανεπάρκεια μιτροειδούς. Στην προεφηβεία μπορεί να εμφανίζουν αυξημένο όγκο όρχεων. Καλό είναι να παρακολουθούνται οι πάσχοντες με υπερηχογράφημα κοιλίας, επειδή έχουν παρατηρηθεί κύστεις, αλλά και κακοήθειες ήπατος. Ο βαθμός της νοητικής υστέρησης ποικίλλει και μπορεί να συνυπάρχει με αυτιστική συμπεριφορά και διάσπαση προσοχής, αλλά και με σπασμούς. Περίπου το 25%-35% των πασχόντων αγοριών πληροί τα διαγνωστικά κριτήρια αυτισμού. Δυσκολίες στην κοινωνική προσαρμοστικότητα και διαταραχές συμπεριφοράς παρατηρούνται κυρίως στα αγόρια, αλλά και συχνά στα κορίτσια, αν και σε αυτά δεν υπάρχει νευρολογική διαταραχή.
Σε ορισμένα γενεαλογικά δέντρα αξιολογείται η ύπαρξη θετικού οικογενειακού ιστορικού νοητικής υστέρησης, όπως και η παρουσία ανδρών υπερηλίκων στην οικογένεια που εμφανίζουν απώλεια πρόσφατης μνήμης, τρόμο τελικού σκοπού, παρεγκεφαλιδική αταξία, περιφερική νευροπάθεια και νόσο του Parkinson.
Πρόκειται για φορείς προμετάλλαξης στους οποίους η συμπτωματολογία εκδηλώνεται μετά την ηλικία των 50 χρόνων, ονομάζεται FXTAS (fragile X tremor-ataxia syndrome, OMIM 300623). Οι γυναίκες φορείς προμετάλλαξης είναι πιθανόν να εμφανίσουν πρώιμη ωοθηκική ανεπάρκεια (premature ovarian failure-POF) που οδηγεί σε εμμηνόπαυση πριν από την ηλικία των 40 ετών.
Η κλινική υποψία επιβεβαιώνεται με εργαστηριακή διάγνωση (μοριακός έλεγχος επέκτασης CGG στην 5΄-UTR του FMR-1), η οποία θα ανιχνεύσει και τους φορείς της προμετάλλαξης. Με τη συνεργασία του συμβούλου γενετικής, μπορεί να προσφερθεί προγεννητική διάγνωση στη μητέρα του πάσχοντος, αλλά και στις πιθανές αδερφές της, καθώς και εντοπισμός των φορέων προμετάλλαξης σε όλο το οικογενειακό δέντρο και γενετική συμβουλή.
Να σημειωθεί ότι σε κανένα κράτος της Ευρώπης δεν έχει ακόμη καθιερωθεί ανιχνευτικό πρόγραμμα για FXS στο γενικό πληθυσμό.
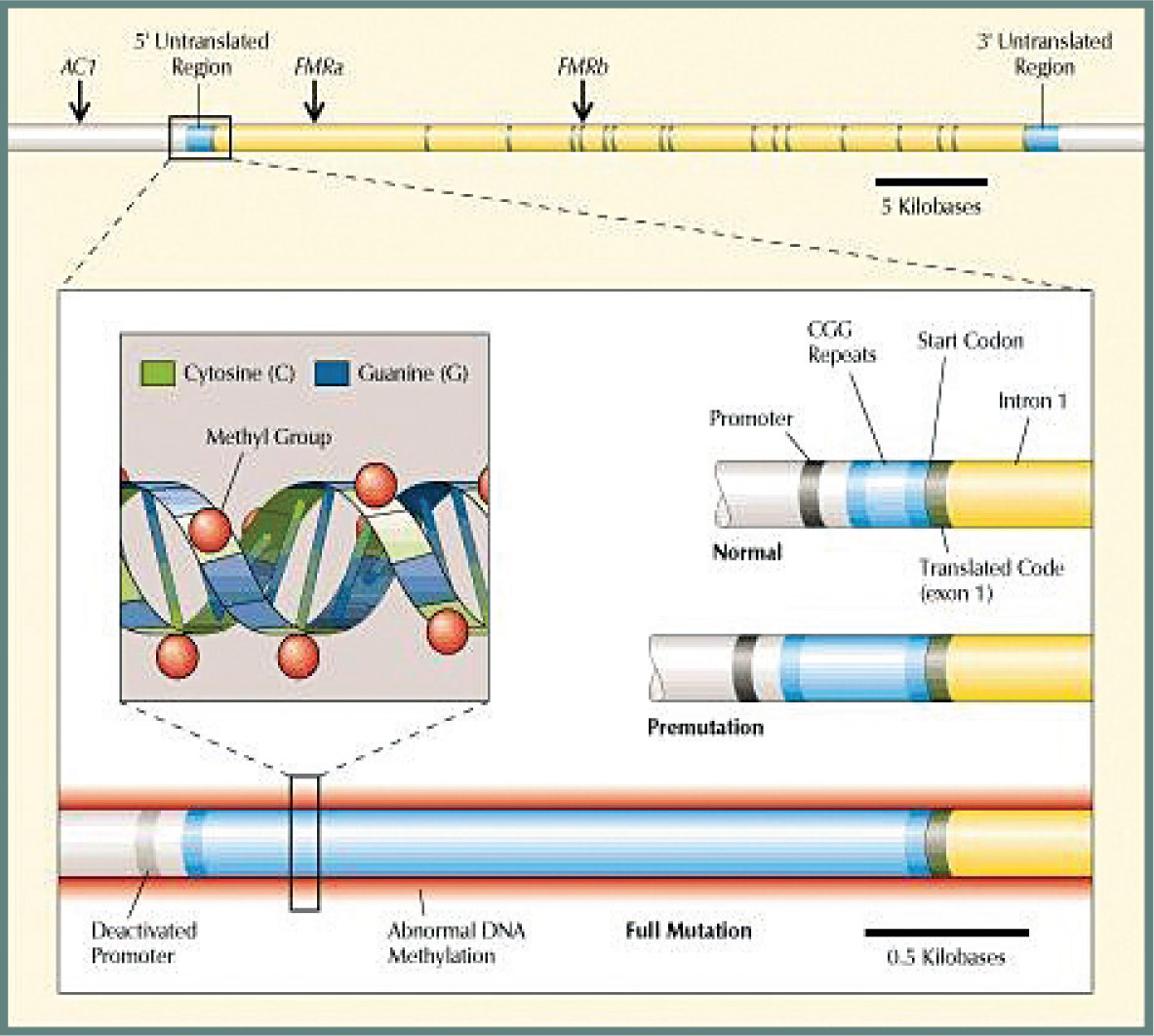
Σχήμα 1: Σχηματική παράσταση της 5΄ αμετάφραστης περιοχής του γονιδίου FMR-1. Στην ένθετη μεγέθυνση αναπαρίστανται 3 διαφορετικά αλληλόμορφα: φυσιολογικό, προμεταλλαγής και πλήρους μεταλλαγής (από την Abbott Molecular).
Νοέμβριος 2012






































