Βρογχοπνευμονική δυσπλασία και προωρότητα
Η βρογχοπνευμονική δυσπλασία (ΒΠΔ) περιγράφηκε για πρώτη φορά από τους Northway και συνεργάτες το 1967 ως σύνδρομο χρόνιας πνευμονικής νόσου σε πρόωρα νεογνά που επιβίωναν από το σύνδρομο αναπνευστικής δυσχέρειας (ΣΑΔ).
Γράφει η
Μένη Σακλαμάκη – Κοντού
Παιδίατρος – Νεογνολόγος
Παίδων ΜΗΤΕΡΑ
Τα νεογνά αυτής της μελέτης παρουσίαζαν συγκεκριμένα κλινικά, ακτινολογικά και ιστολογικά ευρήματα και είχαν κατά μέσο όρο διάρκεια κύησης 32 εβδομάδες και βάρος γέννησης 1.900 g. Οι δύο βασικές αιτιολογικές συσχετίσεις για τη νέα κλινική οντότητα τότε ήταν η εφαρμογή μηχανικού αερισμού (>150 ώρες) και η χορήγηση οξυγόνου σε υψηλές συγκεντρώσεις (Fi Ο2 >80%). Στη συνέχεια πολλές κλινικές και πειραματικές μελέτες επιβεβαίωσαν ότι ο συνδυασμός της τοξικότητας του οξυγόνου και η εφαρμογή μηχανικού αερισμού προκαλούν βλάβες στο πνευμονικό παρέγχυμα και διαταραχές στην επούλωση.
Ο Northway περιέγραψε την εξέλιξη της νόσου σε τέσσερα στάδια με τελική κατάληξη χρόνια αναπνευστική ανεπάρκεια, υποξαιμία, υπερκαπνία και χαρακτηριστικά ακτινολογικά ευρήματα IV σταδίου, με γραμμοειδείς διηθήσεις λόγω ίνωσης, εναλλασσόμενες με περιοχές υπεραερισμού. Τα χαρακτηριστικά ιστολογικά ευρήματα ήταν φλεγμονή, βλάβη του επιθηλίου των αεροφόρων οδών, υπερτροφία των λείων μυϊκών ινών των αεραγωγών, σοβαρές υπερτασικές αλλοιώσεις των πνευμονικών αγγείων, εναλλασσόμενες περιοχές ατελεκτασίας – εμφυσήματος και εκτεταμένη ίνωση. Στη μακροχρόνια παρακολούθηση στην ηλικία των 14 – 23 ετών τα παιδιά αυτά παρουσίαζαν σοβαρά αναπνευστικά προβλήματα, με πνευμονική υπέρταση, δεξιά καρδιακή ανεπάρκεια (cor pulmonale), βρογχομαλακία με κυανωτικές κρίσεις και αυξημένη νοσηρότητα. Ο αρχικός ορισμός της ΒΠΔ περιελάμβανε και την ανάγκη για οξυγόνο πέραν των 28 ημερών.
Τα τελευταία 25 χρόνια έχει σημειωθεί σημαντική πρόοδος στην εντατική νοσηλεία των πρόωρων νεογνών, με αποτέλεσμα τη θεαματική αύξηση της επιβίωσης, ειδικά των εξαιρετικά χαμηλού βάρους γέννησης (ΕΧΒΓ) πρόωρων νεογνών (ΒΓ
«Νέα ΒΠΔ»
Το 1999 ο Jobe χρησιμοποίησε τον όρο «νέα ΒΠΔ» για να περιγράψει την αναδυόμενη νέα οντότητα. Η νέα ΒΠΔ αφορά σε μικρά πρόωρα
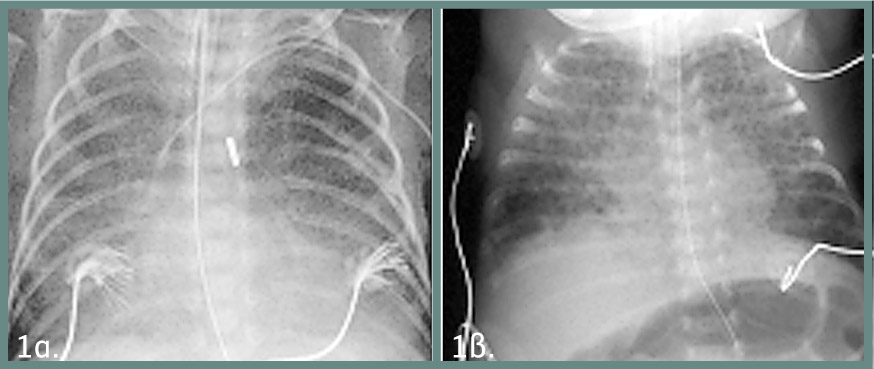
Η ακτινολογική εικόνα παρουσιάζει ήπια διάχυτη θολερότητα άμφω χωρίς ατελεκτασίες, γραμμοειδείς διηθήσεις ή περιοχές υπεραερισμού των πνευμόνων, σε αντίθεση με την κλασική ΒΠΔ (εικόνα 1).
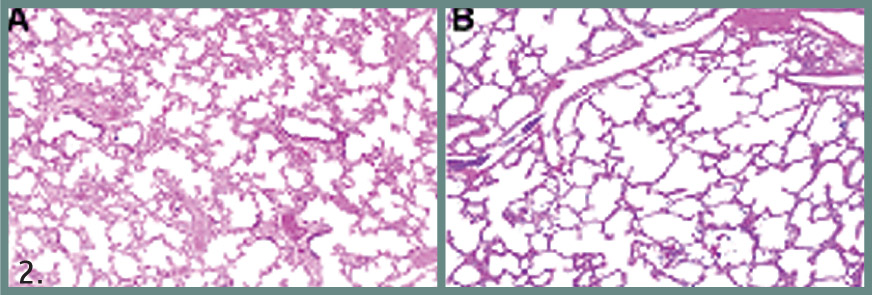
Η ιστοπαθολογική εικόνα της νέας ΒΠΔ χαρακτηρίζεται από ήπια ή μηδενική βλάβη του επιθηλίου των αεροφόρων οδών, ελάχιστη ίνωση στους πνεύμονες, ενώ κυριαρχεί η αναστολή της κυψελιδοποίησης και της μικροαγγειογένεσης. Χαρακτηριστικοί είναι οι μεγάλοι απλοποιημένοι αεροφόροι χώροι, κυψελίδες μεγάλες σε μέγεθος, αλλά μειωμένες σε αριθμό και τα ανώμαλα δυσμορφικά αγγεία (εικόνα 2).
Η νέα ΒΠΔ είναι μία πολυπαραγοντική νόσος, όχι ακόμη πλήρως κατανοητή. Η φλεγμονή φαίνεται να έχει κεντρικό ρόλο στην παθογένεια της νόσου. Βλαπτικοί παράγοντες πριν και μετά τη γέννηση μπορεί να προκαλέσουν ή να ενισχύσουν μια περίπλοκη φλεγμονώδη αντίδραση στις κυψελίδες και στον διάμεσο πνευμονικό ιστό, μέσω αυξημένης παραγωγής προφλεγμονωδών κυτταροκινών, με τελική κατάληξη την εκδήλωση της νέας ΒΠΔ.
Στους προγεννητικούς παράγοντες περιλαμβάνονται η χοριοαμνιονίτιδα και η πιθανή γενετική προδιάθεση. Στους μεταγεννητικούς περιλαμβάνονται η μηχανική βλάβη του πνεύμονα από την έντονη ανάνηψη κατά τη σταθεροποίηση του νεογνού αμέσως μετά τον τοκετό καθώς και η τοξικότητα από τη χορήγηση οξυγόνου σε υψηλές συγκεντρώσεις κατά την ανάνηψη. Τέλος, κατά την περαιτέρω παραμονή του νεογνού στη ΜΕΝΝ, επιπρόσθετοι βλαπτικοί παράγοντες είναι το ογκότραυμα και το βαρότραυμα από τη μηχανική υποστήριξη της αναπνοής, λοιμώξεις, η παραμονή ανοιχτού βοτάλλειου πόρου και η ανεπαρκής θρέψη του νεογνού.
Η χοριοαμνιονίτιδα, ειδικότερα, είναι σημαντικό αίτιο πρόωρου τοκετού και μπορεί να προκαλέσει ενδομήτρια φλεγμονώδη αντίδραση του εμβρύου, και ιδιαίτερα του εμβρυϊκού πνεύμονα, και να αποτελέσει σημαντικότατο παράγοντα κινδύνου για μεγαλύτερη ανάπτυξη ΒΠΔ. Ο εμβρυϊκός πνεύμονας μολύνεται απευθείας με την εισπνοή μολυσμένου αμνιακού υγρού με τις πρόωρες αναπνευστικές κινήσεις του εμβρύου. Μικροοργανισμοί, κυρίως Ureaplasma Urealyticum, ή συστατικά του κυτταρικού τοιχώματος μικροβίων, αλλά και ενδοτοξίνη μικροβίων (LPS) προκαλούν διέγερση κυρίως των κυψελιδικών και των πνευμονικών μακροφάγων, τα οποία παράγουν προφλεγμονώδεις κυτταροκίνες IL-6, IL-1β, IL-8 και TNFα.
Οι αυξημένες προφλεγμονώδεις κυτταροκίνες οδηγούν σε συσσώρευση φλεγμονωδών κυττάρων (ουδετερόφιλων και μακροφάγων) στις κυψελίδες και αυξημένη παραγωγή ελεύθερων ριζών οξυγόνου και ενεργών πρωτεασών, καταστροφή της κυψελιδοτριχοειδικής μεμβράνης και της διάμεσης ουσίας του πνεύμονα και διαταραχή των μηχανισμών επούλωσης και ανάπλασης των κυψελίδων και της αγγειογένεσης, διαταραχές που χαρακτηρίζουν τη νέα ΒΠΔ.
Θεραπευτική αντιμετώπιση
Η θεραπευτική προσέγγιση της ΒΠΔ περιλαμβάνει μέτρα που στοχεύουν αφενός στην πρόληψη εκδήλωσης ΒΠΔ και αφετέρου στην αντιμετώπιση της ήδη εγκατεστημένης νόσου. Η πρόληψη, γενικότερα, αποβλέπει στην έγκαιρη αντιμετώπιση βλαπτικών παραγόντων, που μπορεί να δράσουν προγεννητικά κατά τη διάρκεια της εγκυμοσύνης, αμέσως μετά τον τοκετό κατά τη σταθεροποίηση του νεογνού ή μετά τη γέννηση, κατά την παραμονή του στη ΜΕΝΝ.
Μέτρα πρόληψης ΒΠΔ
- Προγεννητική προστασία έναντι ΒΠΔ
Αυτή αποβλέπει στην αποφυγή του πρόωρου τοκετού με τη χορήγηση προγεστερόνης και αντιβιοτικών, όπου αυτά ενδείκνυνται, και ιδιαίτερα σε πρόωρη ρήξη υμένων. Επίσης, στη χορήγηση γλυκοκορτικοειδών για αύξηση της πνευμονικής ωρίμανσης του εμβρύου. Τέλος, στην έγκαιρη αντιμετώπιση της κλινικής χοριοαμνιονίτιδας, με χορήγηση αντιβιοτικών ευρέος φάσματος ενδοφλεβίως και πρόκληση τοκετού, προκειμένου να αποφευχθεί ο κίνδυνος ενδομήτριας φλεγμονώδους αντίδρασης του εμβρύου.
- Μέτρα πρόληψης ΒΠΔ αμέσως μετά τον τοκετό
Κατά τη σταθεροποίηση του νεογνού, αμέσως μετά τη γέννηση, στην αίθουσα τοκετών και στο χειρουργείο πρέπει:
• Να αποφεύγεται ο μηχανικός τραυματισμός του ευαίσθητου πνεύμονα του νεογέννητου από την έντονη ανάνηψη με τη χρήση μάσκας και ασκού (ambu) και να χρησιμοποιείται η ειδική συσκευή Neopuff.
• Να αποφεύγεται η ανάνηψη με 100% O2. Συνιστάται η χορήγηση 21% οξυγόνου στα τελειόμηνα και 30% στα πρόωρα και η σταδιακή αύξηση του οξυγόνου ανάλογα με τις ανάγκες του νεογνού. Επιβάλλεται η συνεχής παρακολούθηση του κορεσμού του οξυγόνου καθώς και του καρδιακού ρυθμού με τη χρήση παλμικού οξυμέτρου.
- Μέτρα πρόληψης ΒΠΔ στη ΜΕΝΝ
Κατά την παραμονή του πρόωρου νεογνού στη ΜΕΝΝ, συνιστώνται ο περιορισμός της συχνότητας διασωλήνωσης και της διάρκειας μηχανικού αερισμού, η εφαρμογή ήπιων μεθόδων μηχανικής υποστήριξης της αναπνοής, η χορήγηση επιφανειοδραστικού παράγοντα, όπου ενδείκνυται, και η αποφυγή καταστάσεων υπεροξίας ή υποξίας με τη χρήση παλμικού οξυμέτρου. Επιθυμητοί κορεσμοί οξυγόνου ανάλογα με την ωριμότητα των πρόωρων νεογνών θεωρούνται αυτοί με ποσοστό 90% – 95%.
Στις παρεμβάσεις μας για την πρόληψη της ΒΠΔ περιλαμβάνεται και η εξωγενής χορήγηση εισπνεόμενου μονοξειδίου του αζώτου (iNO), επειδή προάγει την αγγειογένεση και έχει αντιοξειδωτικές και αντιφλεγμονώδεις ιδιότητες. Όμως, οι διεθνείς οδηγίες δεν συνιστούν τη γενικευμένη χορήγησή του, τουλάχιστον προς το παρόν.
Στα φάρμακα που χορηγούνται προληπτικά για τη μείωση της συχνότητας της ΒΠΔ περιλαμβάνονται η καφεΐνη και η βιταμίνη Α. Επίσης, έχουν δοκιμαστεί η βιταμίνη Ε, η ινοσιτόλη και τελευταία, πειραματικά, αντιοξειδωτικά φάρμακα, όπως το υπεροξείδιο της δισμουτάσης, η Ν-ακετυλοκυστεΐνη και η αλλοπουρινόλη.
Θεραπεία της εγκατεστημένης ΒΠΔ
Για τη θεραπεία της εγκατεστημένης νόσου έχουν δοκιμαστεί κορτικοειδή, διουρητικά, βρογχοδιασταλτικά καθώς και άλλα νεότερα φάρμακα.
Κορτικοειδή: Έχουν χρησιμοποιηθεί κυρίως η δεξαμεθαζόνη, η υδροκορτιζόνη καθώς και εισπνεόμενα κορτικοειδή. Τα κορτικοειδή μειώνουν τον χρόνο για αποσωλήνωση, τη συχνότητα και τη βαρύτητα της ΒΠΔ και τη θνησιμότητα στη διορθωμένη ηλικία των 28 και 36 εβδομάδων κύησης. Όμως, παρουσιάζουν σημαντικές βραχυπρόθεσμες και μακροπρόθεσμες παρενέργειες, κυρίως η δεξαμεθαζόνη και κυρίως από το ΚΝΣ, λόγω τοξικής εκφυλιστικής δράσης στους γλυκοκορτικοειδείς υποδοχείς του ιππόκαμπου, με επακόλουθα αυξημένο κίνδυνο για εγκεφαλική παράλυση, ανώμαλη νευρολογική εξέταση και αναπτυξιακές διαταραχές. Για τον λόγο αυτόν, επιτρέπεται επιλεκτικά η χορήγησή τους σε χαμηλές δόσεις για βραχύ χρονικό διάστημα 3 – 5 ημερών, μετά τη 2η εβδομάδα ζωής, προκειμένου να επιτευχθεί η αποσωλήνωση νεογνών με ΣΑΔ.
Διουρητικά: Τα διουρητικά (φουροσεμίδη, θειαζίδες, σπειρονολακτόνη) χρησιμοποιούνται διότι μειώνουν το οίδημα στους πνεύμονες νεογνών με ΒΠΔ, βελτιώνουν την πνευμονική ενδοτικότητα και περιορίζουν τις πνευμονικές αντιστάσεις.
Βρογχοδιασταλτικά: Τα βρογχοδιασταλτικά, όπως οι εισπνεόμενοι β2-αδρενεργικοί διεγέρτες και τα εισπνεόμενα αντιχολινεργικά φάρμακα, βελτιώνουν την πνευμονική λειτουργία και μπορούν να χρησιμοποιηθούν για βραχύ χρονικό διάστημα.
Τέλος, νεότερα φάρμακα, όπως η Sildenafil (Viagra) και άλλα αντιφλεγμονώδη, δοκιμάζονται ακόμη πειραματικά.
Διατροφή
Τα νεογνά με ΒΠΔ βρίσκονται σε παρατεταμένη καταβολική φάση, με διαταραχή της διαδικασίας επούλωσης του πνεύμονα. Συνιστώνται αυξημένη θερμιδική κάλυψη (130 – 150 Kcal/kg/ημέρα), αυξημένη πρόσληψη πρωτεϊνών (3,5 – 4 g/kg/ημέρα) και περιορισμένη χορήγηση υγρών (150 ml/kg/ημέρα), με έγκαιρη και επαρκή ολική παρεντερική διατροφή. Κατά την από το στόμα σίτιση, χορήγηση γαλάτων για πρόωρα νεογνά με αυξημένες θερμίδες (έως 30 kcal/oz) και εμπλουτισμός του μητρικού γάλακτος με ειδικούς ενισχυτές.
Έκβαση νεογνών με ΒΠΔ
Τα νεογνά με ΒΠΔ παρουσιάζουν μειωμένη ανάπτυξη κατά την παραμονή τους στη ΜΕΝΝ και κατά την έξοδό τους από το νοσοκομείο. Η υπολειπόμενη σωματική ανάπτυξη παρατηρείται έως και τη διορθωμένη ηλικία των 2 ετών. Αργότερα, κατά την παιδική ηλικία, η ανάπτυξή τους παραμένει οριακά χαμηλή, αυτό όμως οφείλεται στη συμμετοχή και άλλων παραγόντων. Η ΒΠΔ ακόμα συνδέεται με αυξημένο κίνδυνο νευροαναπτυξιακών διαταραχών, οι οποίες αφορούν σε γνωστικές και αδρές και λεπτές κινητικές λειτουργίες στην προσχολική και σχολική ηλικία έως και την εφηβεία. Ο κίνδυνος και ο βαθμός βαρύτητας των διαταραχών σχετίζεται με τη βαρύτητα της ΒΠΔ. Όσον αφορά στην αναπνευστική λειτουργία, τα βρέφη με ΒΠΔ παρουσιάζουν αυξημένη ευαισθησία στις λοιμώξεις αναπνευστικού, οι οποίες έχουν χειρότερη εξέλιξη, ιδιαίτερα οι λοιμώξεις από τον ιό RSV. Επιβάλλεται ο εμβολιασμός των βρεφών αυτών με εξανθρωποποιημένο μονοκλωνικό αντίσωμα έναντι του ιού RSV (Palivizumab).
Επίσης, τα βρέφη με ΒΠΔ παρουσιάζουν αυξημένη συχνότητα επανεισαγωγής στο νοσοκομείο τον πρώτο χρόνο ζωής. Τέλος, εμφανίζουν συχνά επεισόδια υποτροπιάζοντος συριγμού, που μιμείται την εικόνα άσθματος, κατά την παιδική και εφηβική ηλικία, με διαφορετική όμως υποκείμενη παθοφυσιολογία και απάντηση στα βρογχοδιασταλτικά. Τα κλινικά συμπτώματα από το αναπνευστικό έχουν τάση υποχώρησης με τον χρόνο.
ΒΠΔ και μελλοντικοί στόχοι
Τα τελευταία χρόνια το ερευνητικό ενδιαφέρον έχει στραφεί στην αναζήτηση πιθανού γενετικού υπόβαθρου στην ανάπτυξη της ΒΠΔ. Μελέτες διδύμων έδειξαν ότι η ανάπτυξη ΒΠΔ στο ένα από τα δίδυμα είναι προγνωστική για την ανάπτυξη ΒΠΔ και στο άλλο. Η συμμετοχή των γενετικών παραγόντων ανέρχεται στο 35% – 65% στις διάφορες μελέτες. Αναζητούνται γονίδια σχετιζόμενα με τις αποπρωτεΐνες του επιφανειοδραστικού παράγοντα και τους παράγοντες φλεγμονής, που αναμένεται να ανοίξουν νέους ορίζοντες στην αντιμετώπιση της νόσου.
Σημαντική, επίσης, είναι η ερευνητική προσπάθεια για την ανίχνευση βιολογικών δεικτών σε τραχειακές εκκρίσεις, ούρα και αίμα για τον πρώιμο εντοπισμό νεογνών αυξημένου κινδύνου για ανάπτυξη ΒΠΔ. Ο κατάλογος των εμπλεκόμενων δεικτών είναι μεγάλος και ελπίζεται ότι μελλοντικά η απομόνωση σταθερών βιολογικών δεικτών, κυρίως από αίμα και ούρα πρόωρων νεογνών με ΣΑΔ, θα αποτελέσει σημαντικό όπλο για την έγκαιρη διάγνωση και αντιμετώπιση της ΒΠΔ.
Στους στόχους του μέλλοντος περιλαμβάνεται και η δυνατότητα χρησιμοποίησης βλαστοκυττάρων για την αντιμετώπιση της ΒΠΔ. Τα αποτελέσματα από την πειραματική χορήγηση μεσεγχυματικών κυττάρων από μυελό των οστών, ενδοτραχειακά σε αρουραίους και ενδοφλέβια σε άλλα ποντίκια, είναι ενθαρρυντικά. Ελπίζεται ότι αρχέγονα ενδοθηλιακά κύτταρα από αίμα ομφάλιου λώρου νεογνών ή και προϊόντων των βλαστοκυττάρων μπορούν να αποτελέσουν τη μελλοντική λύση στη θεραπεία της ΒΠΔ, η οποία εξακολουθεί να είναι σημαντικός παράγοντας νοσηρότητας και θνησιμότητας για τα ΕΧΒΓ πρόωρα νεογνά.
Bιβλιογραφία
1. Northway WH Jr, Rosan RC, Porter DY. Pulmonary disease following respirator therapy of hyaline-membrane disease. Bronchopulmonary dysplasia. N Engl J Med. 1967; 276:357 – 368.
2. Northway WH Jr, Moss RB, Carlisle KB, et al. Late pulmonary sequelae of bronchopulmonary dysplasia. N Engl J Med. 1990; 323:1.793 – 1.799.
3. Stoll BJ, Hansen NI, Bell EF, et al. Neonatal outcomes of extremely preterm infants from the NICHD Neonatal Research Network. Pediatrics. 2010; 126:443 – 456.
4. Bhandari A, Bhandari V. Pitfalls, problems, and progress in bronchopulmonary dysplasia. Pediatrics. 2009; 123:1.562 – 1.573.
5. Jobe AJ. The new BPD: an arrest of lung development. Pediatr Res. 1999; 46:641 – 643.
6. Coalson JJ. Pathology of bronchopulmonary dysplasia. Semin Perinatol. 2006; 30:179 – 184.
7. Speer CP. Chorioamnionitis, postnatal factors and proinflammatory response in the pathogenetic sequence of bronchopulmonary dysplasia. Neonatology. 2009; 95:353 – 361.
8. Bhandari V, Gruen JR. The genetics of bronchopulmonary dysplasia. Semin Perinatol. 2006; 30:185 – 191.
9. Jobe AH. The new bronchopulmonary dysplasia. Curr Opin Pediatr. 2011; 23:167 – 172.
10. Vento M, Saugstad OD. Oxygen supplementation in the delivery room: updated information. J Pediatr. 2011; 158(2 Suppl):e5 – 7.
11. Jobe AH. Let’s feed the preterm lung. J Pediatr (Rio J). 2006; 82:165 – 166.
12. Saugstad OD, Ramji S, Soll RF, Vento M. Resuscitation of newborn infants with 21% or 100% oxygen: an updated systematic review and meta-analysis. Neonatology. 2008; 94:176 – 182.
13. Sweet DG, Carnielli V, Greisen G, et al. European consensus guidelines on the management of neonatal respiratory distress syndrome in preterm infants – 2010 update. Neonatology. 2010; 97:402 – 417.
14. Thomas W, Speer CP. Nonventilatory strategies for prevention and treatment of bronchopulmonary dysplasia – what is the evidence? Neonatology. 2008; 94:150 – 159.
15. Cole FS, Alleyne C, Barks JD, et al. NIH Consensus Development Conference statement: inhaled nitric-oxide therapy for premature infants. Pediatrics. 2011; 127:363 – 369.
16. Watterberg KL. Policy statement-postnatal corticosteroids to prevent or treat bronchopulmonary dysplasia. Pediatrics. 2010; 126:800 – 808.
17. Anderson PJ, Doyle LW. Neurodevelopmental outcome of bronchopulmonary dysplasia. Semin Perinatol. 2006; 30:227 – 232.
18. Fakhoury KF, Sellers C, Smith EO, et al. Serial measurements of lung function in a cohort of young children with bronchopulmonary dysplasia. Pediatrics. 2010; 125:e1.441 – 1.447.
19. Borghesi A, Massa M, Campanelli R, et al. Circulating endothelial progenitor cells in preterm infants with bronchopulmonary dysplasia. Am J Respir Crit Care Med. 2009; 180:540 – 546.
Νοέμβριος 2011










































